
| A. | 加入2mL0.1mol•L-1盐酸 | B. | 加入2mL0.1mol•L-1氢氧化钡溶液 | ||
| C. | 加入2mL0.1mol•L-1硫酸铜溶液 | D. | 加入2mL0.1mol•L-1氨水 |
科目:高中化学 来源: 题型:选择题
| A. | 含H+的溶液显酸性 | |
| B. | 加热蒸馏水,Kw变大,pH变小 | |
| C. | 常温下,0.01mol•L-1的Ba(OH)2溶液pH为12 | |
| D. | 醋酸溶液加水稀释,所有离子的浓度都减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用核磁共振氢谱鉴别1-丙醇和2-丙醇 | |
| B. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色 | |
| C. | 间二溴苯仅有一种空间结构可证明苯分子中不存在单双键交替的结构 | |
| D. | 甲烷、乙烯和苯在工业上都可通过石油分馏得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原剂是HCl,氧化剂是MnO2 | |
| B. | 每消耗1 mol HCl,转移电子的物质的量为2 mol | |
| C. | 每生成1 mol Cl2,转移电子的物质的量为2 mol | |
| D. | 生成的Cl2中,除含有一些水蒸气外,还含有HCl杂质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{117}^{293}$Up和${\;}_{117}^{294}$Up属于同种核素 | |
| B. | ${\;}_{117}^{293}$Up和${\;}_{117}^{294}$Up互为同位素 | |
| C. | ${\;}_{117}^{293}$Up和${\;}_{117}^{294}$Up的中子数不同,化学性质不同 | |
| D. | ${\;}_{117}^{293}$Up和${\;}_{117}^{294}$Up的质量数不同、电子数也不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在已知元素中具有最大的原子半径 | B. | 其单质的熔点比金属钠的熔点高 | ||
| C. | 氧化物对应的水化物是极强的碱 | D. | 金属钫与氧气或水反应非常剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
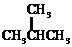 和
和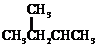
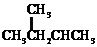
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
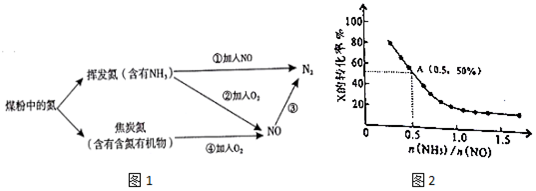
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com