
【选修2化学与技术】(15分)
由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下: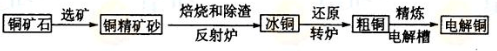
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000℃左右,黄铜矿与空气反应
生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。该过程中两个主
要反应的化学方程式分别是 、
,反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%--50%。转炉中,将冰铜加
熔剂(石英砂)在1200℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化为Cu2O,生成Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是 、 ;
(3)粗铜的电解精炼如右图所示。在粗铜的电解过程中,粗铜板应是图中电极_ _(填图中的字母);在电极d上发生的电极反应式为 ;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为 。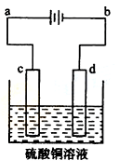
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
(10分)电解原理和原电池原理是电化学的两个重要内容。某兴趣小组做如下探究实验: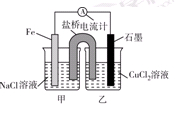
Ⅰ.(1)如图为某实验小组依据氧化还原反应:(用离子方程式表示)_______________________________设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过________mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为________________________,这是由于NH4Cl溶液显________(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因____________________________________________。
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,则乙装置中石墨(1)为________极(填正、负、阴、阳),乙装置中与铜线相连石墨电极上发生的反应式为_________________________________。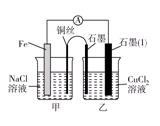
Ⅱ.如右图所示装置,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL。
请完成下列问题: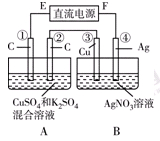
①第②极上生成的物质为________mol。
②写出第①极上发生反应的电极反应式_________________________。
③设A池中原混合液的体积为200 mL,则通电前A池原混合液中Cu2+的浓度为________ mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
南海某小岛上,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示水的硬度为280(属于硬水),主要含钙离子、镁离子、氯离子和硫酸根离子。请回答下列问题。
(1)该泉水属于 硬水(填写“暂时”或“永久”)。
(2)若要除去Ca2+、Mg2+可以往水中加入石灰和纯碱,试剂加入时的先后次序是 ,原因是 。
(3)目前常用阴、阳离子交换树脂来进行硬水的软化,如水中的Ca2+、Mg2+可与交换树脂中的 交换。当阴离子交换树脂失效后可放入 溶液中再生。
(4)岛上还可以用海水淡化来获得淡水。右边是海水利用电渗析法获得淡水的原理图,已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42-等离子,电极为惰性电极。请分析下列问题:
①阳离子交换膜是指 (填A或B);
②写出通电后阳极区的电极反应式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
化工原料红矾钠(重铬酸钠:Na2Cr2O7?2H2O)主要是以铬铁矿(主要成份为FeO?Cr2O3,还含有A12O3、 SiO2等杂质)为主要原料生产,其主要工艺流程如下: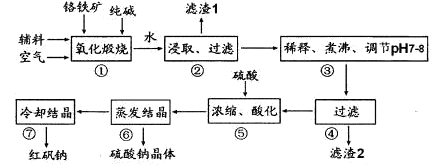
步骤①中主要反应的化学方程式为:4FeO·Cr2O3+8Na2CO3+7O2=8Na2CrO4+2Fe2O3+8CO2
(1)①中反应是在回转窑中进行,反应时需不断搅拌,其作用是 。
(2)杂质A12O3、SiO2在①中转化的化学反应方程式为 。
(3)用化学平衡移动原理说明③中煮沸的作用是 (用离子方程式结合文字说明),若调节pH过低产生的影响是 。
(4)⑤中酸化是使CrO42一转化为Cr2O72一,写出该反应的离子方程式: 。
(5)工业上还可用电解法制备重铬酸钠,其装置示意图如下: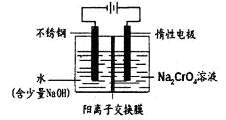
阴极发生的电极反应式为: 。
阳极发生的电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
如图为相互串联的甲乙两电解池
试回答:
(1)甲池若为用电解原理精炼铜的装置,则B是 极,材料是 ,A电极反应为 。
(2)乙池中若滴入少量石蕊试液,电解一段时间后Fe极附近呈 色.
(3)若甲池为电解精炼铜,阴极增重6.4g,则:乙池中阳极放出的气体在标准状况下的体积为 ;若此时乙池剩余液体为400 mL,则电解后得到碱液的物质的量浓度为 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(12分)如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。请按要求回答相关问题: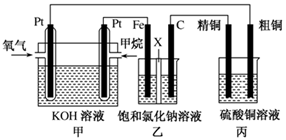
(1)甲烷燃料电池负极反应式是 ;
(2)石墨(C)极的电极反应式为 ;
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁极上生成 的气体体积为________L ,丙装置中阴极析出铜的质量为________g ;
(4)某同学利用甲烷燃料电池设计电解法制取漂白液或Fe(OH)2的实验装置(如图所示)。
若用于制漂白液,a为电池的________极,电解质溶液最好用________;若用于制Fe(OH)2,使用硫酸钠作电解质溶液,阳极选用________作电极。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
A、J是日常生活中常见的两种金属,这两种金属和NaOH组成原电池,A作负极;F常温下是气体单质,各物质有以下的转化关系(部分产物及条件略去)。
请回答以下问题:
(1)写出该原电池的总反应方程式_____________________。
(2)写出②的化学方程_________________。
(3)常温时pH=12的C溶液中,溶质的阳离子与溶质的阴离子浓度之差为 。(写出计算式)
(4)若③中J的氧化物为磁性氧化物,且每生成1mol J放出Q kJ的热量,请写出A→J反应的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某同学在探究废干电池内的黑色固体回收利用时,进行如图所示实验:
查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1)操作①的名称是 ;
(2)操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、 、泥三角和三脚架;操作③灼烧滤渣中的黑色固体时,产生一种无色无味能使澄清石灰水变浑浊的气体,由此推测灼烧前的滤渣中存在的物质有 。
(3)往操作④的试管中加入操作③灼烧后所得黑色固体,试管中迅速产生能使带火星的木条复燃的气体,据此可初步认定灼烧后的黑色固体为 , 操作④相关的化学方程式为 。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4+,该同学取少许滤液于试管中 (填写操作与现象),则证实滤液中含有NH4+。
(5)该同学利用在废旧干电池中回收的Zn片和石墨电极,设计一个原电池实验,比较铜与锌的金属活动性强弱。
限用材料:铜片、锌片、石墨电极、稀硫酸、CuSO4溶液、ZnSO4溶液;
限用仪器:直流电源、电流计、导线、烧杯、试管、盐桥等中学化学常见的药品和仪器
请画出实验装置图,并作相应标注,同时写出正极方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某有机物A用质谱仪测定如图①,核磁共振氢谱示意图如图②,则A的结构简式可能为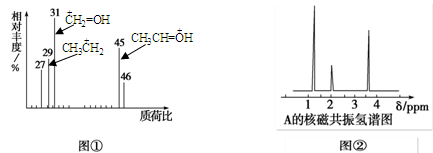
| A.HCOOH | B.CH3CHO | C.CH3CH2OH | D.CH3CH2CH2COOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com