
| A. | HClO的结构式:H-Cl-O | B. | MgO的电子式:Mg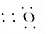 | ||
| C. | 四氯化碳分子比例模型: | D. | 聚四氟乙烯的结构简式: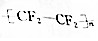 |
科目:高中化学 来源: 题型:填空题
| 化学键 | H-H | N-H | N≡N |
| 键能/kJ•mol-1 | 436 | a | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸发皿中加热胆矾晶体制无水硫酸铜 | |
| B. | 用向下排空气法收集NO2气体 | |
| C. | 用K3[Fe(CN)6]溶液检验FeCl2溶液中的Fe2+ | |
| D. | 将CO2与HCl混合气体通过碱石灰可得到纯净的CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 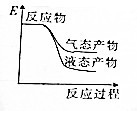 | B. | 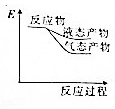 | C. | 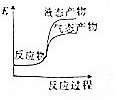 | D. | 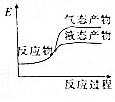 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
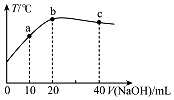 在一隔热系统中,向20.00mL 0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )
在一隔热系统中,向20.00mL 0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol.L-1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )| A. | 若a点溶液呈酸性,此时:c(CH3COO-)-c(CH3COOH)=2c(H+)-2c(OH-) | |
| B. | B.从a到b:$\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$逐渐增大 | |
| C. | 水的电离程度:b点<c点 | |
| D. | 溶液的pH值:a点<c点<b点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com