
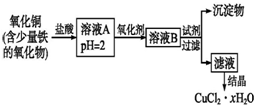
 用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2•xH2O).有如下操作:
用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2•xH2O).有如下操作:分析 用含少量铁的氧化物的氧化铜加盐酸溶解生成氯化铜、氯化铁、氯化亚铁,加氧化剂把亚铁离子氧化为铁离子,再调节pH,铁离子转化为氢氧化铁沉淀,过滤得到的滤液为氯化铜溶液,蒸发浓缩、冷却结晶得到氯化铜晶体,
(1)亚铁离子具有还原性,能被高锰酸钾氧化为三价铁,使高锰酸钾褪色;
(2)加入氧化剂,将Fe2+氧化为Fe3+,易除去,除杂时,不能引入新的杂质;
(3)在制取过程中,不能引进杂质离子,据此来选择合适的试剂;
(4)根据KsP[Fe(OH)3]=4.0×10-38计算;
(5)负极上Fe2+失去电子生成Fe3+.
解答 解:用含少量铁的氧化物的氧化铜加盐酸溶解生成氯化铜、氯化铁、氯化亚铁,加氧化剂把亚铁离子氧化为铁离子,再调节pH,铁离子转化为氢氧化铁沉淀,过滤得到的滤液为氯化铜溶液,蒸发浓缩、冷却结晶得到氯化铜晶体,
(1)亚铁离子具有还原性,能被高锰酸钾氧化为三价铁,使高锰酸钾褪色,是检验溶液A中Fe2+的最佳试剂,故答案为:①;
(2)根据题意,加入氧化剂可把Fe2+氧化为Fe3+,而没有增加新杂质,所以氧化剂为H2O2或是Cl2,KMnO4和HNO3 会引入杂质离子,故答案为:把Fe2+氧化为Fe3+;①④;
(3)得到较纯的产品,需要调节pH使铁离子转化为沉淀,选择的试剂可以是CuO、Cu(OH)2或Cu2(OH)2CO3,而①②均会引入杂质离子,故答案为:③④;
(4)PH为4,则c(OH-)=1.0×10-10mol/L,c(Fe3+)=$\frac{4.0×1{0}^{-38}}{(1×1{0}^{-10})^{3}}$mol/L=4.0×10-8mol/L,故答案为:4.0×10-8mol/L;
(5)负极上Fe2+失去电子生成Fe3+,其负极的电极反应为:Fe2+-e-═Fe3+,故答案为:Fe2+-e-═Fe3+.
点评 本题考查氯化铜晶体的制取实验流程,涉及氧化还原反应、亚铁离子的检验、除杂质、电极方程式的书写等,题目难度中等,答题时注意把握题意,仔细审题.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
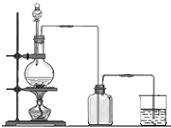 实验室用MnO2和浓盐酸反应制取Cl2,气体发生和收集装置如图.请回答:
实验室用MnO2和浓盐酸反应制取Cl2,气体发生和收集装置如图.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 5.6LN2(标准状况)和11gCO2 | B. | 10gH2和10gO2 | ||
| C. | 9gH2O 和0.5molBr2 | D. | 22.4mlH2 (标准状况)和0.1molN2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
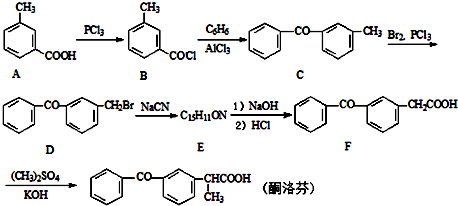
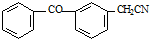 ;由C→D的反应类型是取代反应.
;由C→D的反应类型是取代反应.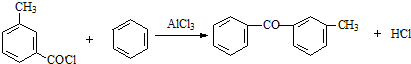 .
. .
.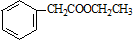 的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$\stackrel{NaOH溶液}{→}$CH3CH2OH
的合成路线流程图(无机试剂可任选).合成路线流程图示例如下:H2C=CH2$\stackrel{HBr}{→}$CH3CH2Br$\stackrel{NaOH溶液}{→}$CH3CH2OH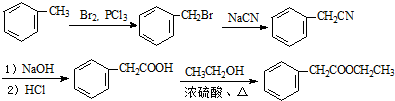 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纯碱溶液能清洗油污:CO32-+2H2O═H2CO3+2OH- | |
| B. | 铜与浓硫酸共热产生气体:Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2↑ | |
| C. | 铁钉在潮湿的空气中很快被腐蚀:Fe-3e-═Fe3+ | |
| D. | 氨气遇到氯化氢时产生白烟:NH3+HCl═NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小苏打是面包发酵粉的主要成分之一 | |
| B. | 碳酸钠可作胃酸的中和剂 | |
| C. | “血液透析”利用了胶体的性质 | |
| D. | 利用明矾溶液的酸性清除铜镜表面的铜锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
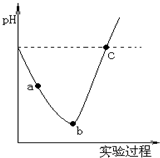 在常温下,取一定量的蒸馏水,然后将Cl2缓慢通入水中至饱和,再向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )
在常温下,取一定量的蒸馏水,然后将Cl2缓慢通入水中至饱和,再向所得饱和氯水中滴加0.1mol/L的NaOH溶液.整个实验进程中溶液的pH变化曲线如图所示,下列叙述正确的是( )| A. | 实验进程中可用pH试纸测定溶液的pH | |
| B. | 向a点所示溶液中能入SO2,溶液的酸性和漂白性均增强 | |
| C. | 由a点到b点的过程中,溶液中c(H+)/c(ClO-)减小 | |
| D. | c点所示的溶液中,c(Na+)=c(ClO-)+c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
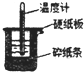 50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com