
【题目】硒(Se)是人体健康必需的一种微量元素。已知Se的原子结构示意图为: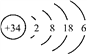 下列说法不正确的是
下列说法不正确的是
A. 该原子的质量数为34 B. 该元素处于第四周期第ⅥA族
C. SeO2既有氧化性又有还原性 D. 酸性:HBrO4 > H2SeO4
科目:高中化学 来源: 题型:
【题目】现有25℃时0.1mol/L的氨水.请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 ![]() (填“增大”、“减小”或“不变”);
(填“增大”、“减小”或“不变”);
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式;所得溶液的pH7(填“>”、“<”或“=”),用离子方程式表示其原因;
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=amol/l,则c(SO ![]() )=;
)=;
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子物质的量浓度由大到小的关系是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:【实验原理】2KMnO4+5H2C2O4+3H2SO4═K2SO4+2MnSO4+10CO2↑+8H2O
【实验内容及记录】
实验编号 | 室温下,试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||
1 | 3.0 | 2.0 | 2.0 | 3.0 | 1.5 |
2 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
3 | 1.0 | 4.0 | 2.0 | 3.0 | 3.9 |
请回答:
(1)根据表中的实验数据,可以得到的结论是 .
(2)利用实验1中的数据,计算用KMnO4表示的化学反应速率为 .
(3)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示.
该小组同学根据图2所示信息提出了新的假设,并继续进行实验探究.
①该小组同学提出的假设是 .
②请你帮助该小组同学完成实验方案,并填写表中空白
实验编号 | 室温下,试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
4 | 2.0 | 2.0 | 3.0 | MnSO4 | t | |
③若该小组同学提出的假设成立,应观察到现象.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用二氧化氯(ClO2)、铁酸钠(Na2FeO4摩尔质量为166g/mol)等新型净水剂替代传统的净水剂Cl2对淡水进行消毒是城市饮用水处理新技术.ClO2和Na2FeO4在水处理过程中分别被还原为Cl﹣和Fe3+ .
(1)如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么,ClO2、Na2FeO4、Cl2三种消毒杀菌剂的消毒效率由大到小的顺序是>> .
(2)Na2FeO4溶于水会放出一种无色无味气体,其杀菌消毒、吸附水中的悬浮杂质的原理可用离子方程式表示为 .
(3)工业以CH3OH与NaClO3为原料在酸性条件下制取ClO2 , 同时产生CO2气体,已知该反应分为两步进行,第一步为2ClO3﹣+2Cl﹣+4H+=2ClO2↑+Cl2↑+2H2O.①写出第二步反应的离子方程式 .
②工业生产时需在反应物中加少量Cl﹣ , 其作用是 .
③生产中会发生副反应ClO3﹣+Cl﹣+H+﹣Cl2↑+H2O(未配平),若测得反应后的混合气体中Cl2的体积分数为3/73,则起始投料时CH3OH与NaClO3的物质的量之比为 .
(4)已知二氧化氯是一种黄绿色有刺激性气味的气体,其熔点为﹣59℃,沸点为11.0℃,易溶于水.ClO2也可以看做是亚氯酸(HClO2)和氯酸(HClO3)的混合酸酐.工业上用稍潮湿的KClO3和草酸在60℃时反应制得.某学生用如图所示的装置模拟工业制取及收集ClO2 , 其中A为ClO2的发生装置,B为ClO2的凝集装置,C为尾气吸收装置.请问:①A部分还应添加温度控制(如水浴加热)装置,B部分还应补充什么装置;
②C中应装的试剂为 . C中发生反应的化学方程式为: . 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学做如下实验,以检验反应中的能量变化.
实验中发现反应后(a)中温度升高,由此可以判断(a)中反应是________热反应;(b)中温度降低,根据能量守恒定律,(b)中反应物的总能量应该________其生成物的总能量.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实写出下列反应的热化学方程式.
(1)1g碳与适量水蒸气反应生成CO和H2 , 需要吸收10.94KJ热量,此反应的热化学方程式为
(2)已知2.0g燃料肼(N2H4)气体完全燃烧生成N2和水蒸气时,放出33.4KJ的热量,则肼燃烧的热化学方程式为
(3)2molAl(s)与适量O2(g)反应生成Al2O3(s),放出1669.8KJ的热量.此反应的热化学方程式为
(4)2.3g某液态有机物和一定量的氧气混合点燃,恰好完全燃烧,生成2.7g液态水和2.24LCO2(标准状况)并放出68.35KJ的热量.写出此反应的热化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着科学技术的不断进步,研究物质的手段和途径越来越多,H3、O4、C60、N5+等已被发现.下列有关说法中,正确的是( )
A.H2与H3属于同素异形体
B.O2与O4属于同位素
C.C60的质量数为720g/mol
D.N5+中含有36个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是现行中学化学教科书中元素周期表的一部分,表中的每个编号表示一种元素,请根据要求回答问题:

(l)②表示的元素是 ______ (填元素符号).
(2)②③④⑤⑧和⑨这六种元素的简单离子半径由小到大排序为:__________(用离子符号表示);上表所示元素中,非金属性最强的是 ______ (填元素符号);⑦⑧⑨这三种元素的最高价氧化物对应的水化物的酸性由强到弱的顺序为:_______________(填分子式)
(3)元素⑨的单质可以用来制取漂白粉,漂白粉的有效成分是 ______ (填化学式);用电子式表示元素⑤与⑨形成化合物的过程 ______ .
(4)上述元素中,单质能与水剧烈反应且水作还原剂,此单质是_________(填化学式)
(5)写出元素④的最高价氧化物对应的水化物与元素⑥的最高价氧化物相互反应的化学方程式 ______ .
(6)某同学为了比较元素⑧和⑨非金属性的相对强弱,用如图所示装置进行实验:
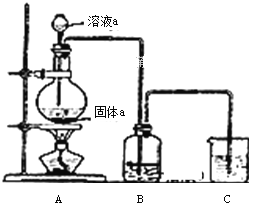
① 装置B中溶液的溶质为______(写化学式).
② 装置C中盛放烧碱稀溶液,目的是______.反应的离子方程式是______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com