
| A. | 用分液漏斗分离环己烷和水的混合液体 | |
| B. | 用浓氨水洗涤做过银镜反应的试管 | |
| C. | 分馏石油时,温度计的末端必须插入液面下 | |
| D. | 配制新制Cu(OH)2溶液时,在2mL10% CuSO4溶液中滴入几滴2%NaOH溶液 |
分析 A.互不相溶的液体采用分液方法分离;
B.Ag不溶于氨水,但能溶于稀硝酸;
C.分馏石油时,温度计测量馏分温度;
D.配制新制Cu(OH)2溶液时,应使碱液过量.
解答 解:A.互不相溶的液体采用分液方法分离,环己烷和水不互溶,二者混合分层,所以可以采用分液方法分离,分液时使用的仪器是分液漏斗,故A正确;
B.Ag不溶于氨水,但能溶于稀硝酸生成可溶性的硝酸银,所以用稀硝酸洗涤做过银镜反应的试管,故B错误;
C.分馏石油时,温度计测量馏分温度,所以温度计水银球应该位于蒸馏烧瓶支管口处,故C错误;
D.配制新制Cu(OH)2溶液时,应使碱液过量,否则不能实现实验目的,故D错误;
故选A.
点评 本题考查化学实验方案评价,为高频考点,侧重考查基本操作、物质的分离和提纯、溶液的配制等知识点,明确实验操作规范性、物质的性质等即可解答,注意C中温度计及冷凝管中水流方向,为易错点.


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:填空题
 依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4 600 | 6 900 | 9 500 |
| Y | 580 | 1 820 | 2 750 | 11 600 |
| A. | 元素X的常见化合价是+1 | |
| B. | 元素Y是第ⅢA族元素 | |
| C. | 元素X与氯形成化合物时,化学式可能是XCl | |
| D. | 若元素Y处于第3周期,它可与冷水剧烈反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 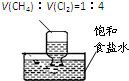 在光照条件下验证甲烷与氯气的反应 在光照条件下验证甲烷与氯气的反应 | |
| B. | 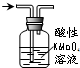 除去甲烷中少量的乙烯得纯净甲烷 除去甲烷中少量的乙烯得纯净甲烷 | |
| C. | 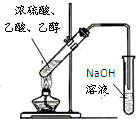 制取并收集乙酸乙酯 制取并收集乙酸乙酯 | |
| D. | 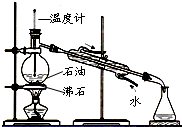 分馏石油并收集60~150℃馏分 分馏石油并收集60~150℃馏分 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | 常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
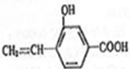 回答下列问题
回答下列问题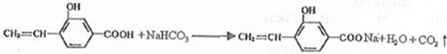
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
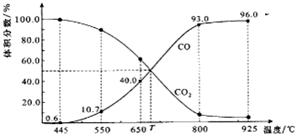 一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:
一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)?2CO(g).平衡时,体系中气体体积分数与温度的关系如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com