
| A. | 5、9、6 | B. | 4、9、6 | C. | 3、9、7 | D. | 5、9、10 |
分析 苯环上有一个侧链,乙苯侧键是碳碳键之间插-NH-,有两种位置,得到两种结构,在碳氢单键之间插-NH-,也有两种位置,氮原子与苯环相连且氮原子连有两个甲基为一种,所以苯环上有一个侧链的结构有5种,若苯环含有2个侧链,有邻,间,对三种取代,苯环上的取代基可以是氨基与乙基、甲基与甲氨基、甲基与氨甲基,故苯环上2个取代基时共9种,若苯环进行3取代,取代基为2个甲基和氨基,有6种产物.
解答 解:苯环上有一个侧链,乙苯侧键是碳碳键之间插-NH-,有两种位置,得到两种结构,在碳氢单键之间插-NH-,也有两种位置,氮原子与苯环相连且氮原子连有两个甲基为一种,故苯环上有1个侧链的结构有5种;
若苯环含有2个侧链,有邻,间,对三种取代,苯环上的取代基可以是氨基与乙基、甲基与甲氨基、甲基与氨甲基,故苯环上有2个侧链的结构有9种;
若苯环含有3个侧链,取代基是-CH3、-CH3、-NH2,两个取代基分为邻、间、对3种结构,
邻二甲苯苯环上氢原子有2种,若连接一个氨基,有2种异构体,
间二甲苯苯环上氢原子有3种,若连接一个氨基,有3种异构体,
对二甲苯苯环上氢原子有1种,若连接一个氨基,有1种异构体,故苯环上有3个侧链的结构有6种;
故选A.
点评 本题主要考查同分异构体数目的判断,利用等效H法是解决此类题目的常用方法,希望认真整理,以便掌握.


科目:高中化学 来源: 题型:实验题
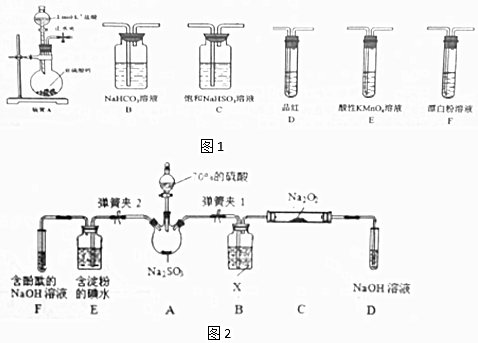
| 操作步骤 | 实验现象 | 解释原因 |
| 关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体 | 若将带火星的木条放在D试管口处,木条不复燃 | SO2与Na2O2反应无O2生成,可能发生的化学反应方程式为①Na2O2+SO2=Na2SO4 |
| 若将带火星的木条放在D试管口处,木条复燃 | SO2与Na2O2反应有O2生成,发生的化学反应为:2SO2+2Na2O2═2Na2SO3+O2 | |
| 关闭弹簧夹1,打开弹簧夹2,残余气体进入E,F中. | E中②E 中溶液蓝色褪去 | E中反应的离子方程式③SO2+I2+2H2O=2I-+SO42-+4H+ |
| F中④F 中红色变浅或褪色 | F中反应为2OH-+SO2═SO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单斜硫转化为正交硫需要吸热 | B. | 单斜硫比正交硫稳定 | ||
| C. | △H4>△H5 | D. | △H4<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在含有弱电解质的溶液中,往往有多个化学平衡共存.
在含有弱电解质的溶液中,往往有多个化学平衡共存.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用装置来制备.
乙酸乙酯广泛用于药物、染料、香料等工业,中学化学实验常用装置来制备.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 35 C1和37Cl | B. | CH3CH2CH2 CH3和CH (CH3)3 | ||
| C. | CH3CH3和CH3CH2CH3. | D. | H2O和H2O2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com