
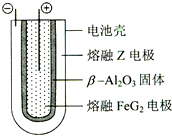
 有X、Y、Z、M、G五种元素,是分属三个短周期并且原子序数依次增大的主族元素.其中X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.完成下列填空:
有X、Y、Z、M、G五种元素,是分属三个短周期并且原子序数依次增大的主族元素.其中X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子.完成下列填空:| 放电 |
| 充电 |
| 放电 |
| 充电 |


科目:高中化学 来源: 题型:
| A、相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量 |
| B、将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
| C、增大压强或升高温度,该反应过程放出更多的热量 |
| D、如将一定量SO2(g)和O2(g)置于某密闭容器中充分反应后放热Q kJ,则此过程中有2 mol SO2(g)被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
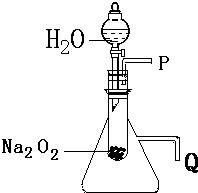 用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住约0.2g过氧化钠粉末,置于石棉网上,向脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衡所需要时间/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L水中所含的分子数约为6.02×1023 | ||
B、标准状况下,aL的氧气和氮气的混合物中含有的分子数约为
| ||
| C、常温常压下,含NA个O3分子的气体的物质的量小于1 mol | ||
| D、28gCO与16gO2的体积比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 锥形瓶编号 | 30% H2O2/mL | 0.1mol?L-1Fe2(SO4)3/mL | 蒸馏水/mL | 反应温度/℃ |
| 1 | 10 | 1 | 0 | 30 |
| 2 | Vx | 1 | 5 | 30 |
查看答案和解析>>
科目:高中化学 来源: 题型:
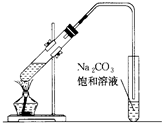 如图是实验室制乙酸乙酯的装置.
如图是实验室制乙酸乙酯的装置.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向饱和Na2CO3溶液中通入足量的CO2,溶液变浑浊,由此证明了NaHCO3溶解度比Na2CO3小 | ||
| B、C(s,石墨)=C(s,金刚石) 该反应吸热熵减,常压下,升温或者降温均为非自发反应 | ||
| C、在铁制品表面镀锌或者镀锡,都是采用外加保护层的方法来防止铁的腐蚀 | ||
D、向0.1mol/L CH3COOH溶液中加入少量的冰醋酸,溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com