
| �� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A |
| 2 | A | B | C | ||||
| 3 | D | E |
| 60�� |
| 275�� |


 ��ʱѵ���������������ϵ�д�
��ʱѵ���������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ͨ������£�1.5 mol O2�����ԼΪ33.6 L |
| B��NaOH��Ħ��������40 g |
| C����100 mLˮ���ܽ�5.85 g NaCl��������NaCl��Һ�����ʵ���Ũ��Ϊ1 mol?L-1 |
| D��ͬ��ͬѹ�£���ͬ������κ����������ķ�����һ����ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
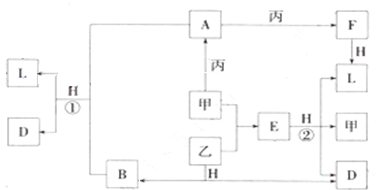
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ||
| A��þ�Ľ�����Բ����ǿ��þ���û���� |
| B��卑ķе��þ�ͣ�����������ʱ��ƽ�������� |
| C��MgCl2�����ȶ��Ա�RbCl�� |
| D��Rb���ʱ�RbCl���ȶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| ��ѧʽ | ���볣�� |
| HClO | K=3��10-8 |
| H2CO3 | K1=4.4��10-7K2=4.7��10-11 |
| A��c��H+��+c��H2CO3���Tc��OH-��+c��CO32-�� |
| B��c��Na+����c��ClO-����c��HCO3-�� |
| C��c��HClO��+c��ClO-���Tc��HCO3-��+c��CO32-��+c��H2CO3�� |
| D��c��Na+��+c��H+���Tc��HCO3-��+c��ClO-��+c��OH-��+c��CO32-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��̼������Һ�Լ��� CO32-+2H2O?H2CO3+2OH- |
| B��̼��������Һ���������ʯ��ˮ HCO3-+Ca2++OH-=CaCO3��+H2O |
| C��FeCl3��Һ��Cu��Ӧ Fe3++Cu=Fe2++Cu2+ |
| D���ð�ˮ��������������̼ NH3?H2O+CO2=NH4++HCO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��NH4HCO3���ڹ�����NaOH��Һ�У�HCO3-+OH-�TCO32-+H2O |
| B���������������Һ�������Һ��Ӧ��2MnO4-+5H2C2O4+6H+�T2Mn2++10CO2��+8H2O |
| C�����Ȼ�������Һ�м��뱥�͵⻯����Һ��Ag++I-�TAgl�� |
| D����100mL0.1mol/L��FeBr2��Һ�л���ͨ���״���µ�672mLCl2��2Fe2++2Br-+2Cl2�T2Fe3++Br2+4Cl- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��K+��NH4+��Cl-��OH - |
| B��Ba2+��K+��SO42-��OH- |
| C��Mg2+��K+��SO42-��H+ |
| D��Ca2+��Cu2+��Cl-��NO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����Һ��c��H+����c��OH-������С |
| B����Һ��c��H+������ |
| C��NH3?H2O����ƽ�������ƶ� |
| D����ҺpH���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com