
【题目】某研究所研制的锌碘液流电池,使用寿命长,可自我恢复。锌碘液流电池充电的工作原理如图所示,下列说法正确的是
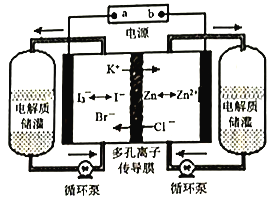
A. 放电时,正极反应式是I3-+2e-=3I-
B. 充电时,b是电源的正极
C. 充电时,外电路通过2mol电子,则有2molK+通过多孔离子传导膜
D. 由电池的电极反应可推出还原性:I->Br- >Cl-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关实验原理或操作正确的是

A. 选择合适的试剂,用图甲可分别制取少量CO2、CO和SO2
B. 洗涤沉淀时(见图乙),向漏斗中加入适量水至浸没沉淀并滤干,重复2-3次
C. 用图丙所示装置除去HCl中的少量CO2
D. 用图丁装置从KI和I2的固体混合物中回收I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲、乙、丙分别表示在不同条件下,可逆反应A(g)+B(g)![]() xC(g)的生成物C的百分含量w(C)和反应时间(t)的关系。
xC(g)的生成物C的百分含量w(C)和反应时间(t)的关系。



(1)若甲中两条曲线分别代表有催化剂和无催化剂的情况,则____曲线代表无催化剂时的情况。
(2)若乙表示反应达到平衡状态后,分别在恒温恒压条件下和恒温恒容条件下向平衡混合气体中充入He后的情况,则_______曲线表示恒温恒容的情况,在该情况下混合气体中w(C)_________(填“变大”“变小”或“不变”)。
(3)根据丙可以判断该可逆反应的正反应是_____(填“放热”或“吸热”)反应,x的值为________(填范围)。
(4)丁表示在某固定容积的密闭容器中,上述可逆反应达到平衡后,某物理量随温度(T)的变化情况,根据你的理解,丁的纵坐标可以是_________________ (填序号)。
①w(C) ②A的转化率 ③B的转化率 ④压强 ⑤c(A) ⑥c(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10-2,K2=5.4×10-5。H2CO3 K1=4.5×10-7 K2= 4.7×10-11 , 草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。回答下列问题:
(1)写出水溶液中草酸的电离方程式:_____________________________________________;
(2)生活中,常用热纯碱溶液清洗油污,纯碱溶液遇酚酞显红色,请用离子方程式解释显红色的原因:________________________________________________________________;
(3)相同条件下等物质的量浓度的Na2C2O4溶液的pH比Na2CO3溶液的pH_____ (填“大”、“小”或“相等”);
(4)向1L 0.02mol/L H2C2O4溶液中滴加1L 0.01mol/L NaOH溶液。混合溶液中c(H+)>c(OH-),下列说法中正确的是(______)
A.c(H2C2O4)>c(HC2O4-) B.c(Na+)+c(H+)=2c(C2O42-)+ c(HC2O4-)+c(OH-)
C.c(OH-)= c(H+)+2c(H2C2O4)+c(HC2O4-) D.c(H2C2O4)+c(C2O42-)+c(HC2O4-)=0.02mol/L
(5)甲同学按照图所示的装置,通过实验检验草酸晶体的分解产物。装置C中可观察到的现象____________________,由此可知草酸晶体分解的产物中有__________________________。装置B的主要作用是_______________________________。

(6)设计实验证明:
①草酸的酸性比碳酸的强_________________________________________________________。
②草酸为二元酸_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯(难溶于水,密度比水大的油状液体)的反应原理,下列关于硝基苯的制备和纯化的装置不正确的是
![]()
A. 浓硫酸与浓硝酸混合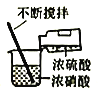
B. 制备硝基苯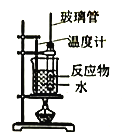
C. 用氢氧化钠溶液分离硝基苯中混有的酸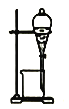
D. 分离硝基苯中混有的苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如表所示为元素周期表的一部分,参照元素①~⑨在表中的位置,请回答下列问题:
ⅠA | 0 | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ⑧ | ⑨ | ② | ③ | ||||
3 | ④ | ⑤ | ⑥ | ⑦ | ||||
(1)③、④、⑦的原子半径由大到小的顺序是________(用元素符号表示)。
(2)下列事实能说明元素②的非金属性比元素⑥的非金属性强的是________(填字母)。
A.②的单质与元素⑥的简单氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1mol②单质比1mol⑥单质得电子多
C.②和⑥两元素的简单氢化物受热分解,前者的分解温度高
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式: ____。
(4)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式:________。
(5)已知W+X=Y+Z(反应需要加热),W、X、Y、Z分别是由①②⑨三种元素形成的四种10电子粒子(W、X为离子,Y、Z为分子),写出该离子方程式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业以浓缩海水为原料提取溴的部分过程如下:

某课外小组在实验室模拟上述过程设计以下装置进行实验(所有橡胶制品均已被保护,夹持装置已略去):

(1)实验开始时,A装置中不通热空气,先通入a气体的目的是(用离子方程式表示)_________。
(2)A装置中通入a气体一段时间后,停止通入,改通热空气。通入热空气的目的是_________。
(3)反应过程中,B装置中Br2与SO2反应的化学方程式____________________。
(4)C装置的作用是___________________。
(5)该小组同学向反应后B装置的溶液中通入氯气,充分反应得到混合液。
①一位同学根据溴的沸点是59℃,提出采用____________________方法从该混合液中分离出溴单质。
②另一位同学向该混合液中加入四氯化碳,充分振荡、静置后放出下层液体,这种方法是________。
(6)某同学提出证明反应后B装置的溶液中含有溴离子的实验方案是:取出少量溶液,先加入过量新制氯水,再加入KI淀粉溶液,观察溶液是否变蓝色。该方案是否合理并简述理由: _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某元素的价类二维图,其中A为正盐,X是一种强碱,通常条件下Z是无色液体,E的相对分子质量比D大16,各物质的转化关系如图所示。下列说法错误的是
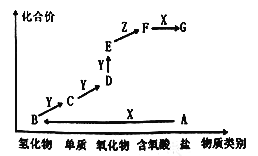
A. A作肥料时不适合与草木灰混合施用
B. 同主族元素的氢化物中B的沸点最低
C. C一般用排水法收集
D. D→E的反应可用于检验D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,可用于水果催熟。A可发生如图所示的一系列 化学反应。

回答下列问题:
(1)C的结构简式为_______________
(2)写出反应③的化学方程式:___________________,该反应是_____________(填反应类型)。
(3)E的相对分子质量是A的两倍,则与A互为同系物的E有________种,写出其中一种的结构简式:_____________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com