
根据已学知识,请你回答下列问题:
(1)试比较含氧酸的酸性强弱(填“>”、“<”或“=”):HClO3 HClO4.
(2)根据价层电子对互斥理论判断:H2O的VSEPR构型为正四面体H3O+的分子立体结构为三角锥.
(3)沸点比较:邻羟基苯甲醛 对羟基苯甲醛(填“>”、“<”或“=”)
(4)在下列物质①NH3、②BF3、③HCl、④SO3,属于非极性分子的是(填番号) .
(5)①苯、②CH3OH、③HCHO、④CS2、⑤CCl4五种有机溶剂中,碳原子采取sp2杂化的分子有(填序号).
(6)三氯化铁常温下为固体,熔点282°C,沸点315°,在300°C以上易升华.易溶于水,也易溶于乙醚、丙酮等有机溶剂.据此判断三氯化铁晶体为 .
(7)配离子[TiCl(H2O)5]2+的中心离子的符号为 ,配位数为 .
考点: 判断简单分子或离子的构型;配合物的成键情况;分子晶体;极性分子和非极性分子;原子轨道杂化方式及杂化类型判断;氢键的存在对物质性质的影响.
分析: (1)判断含氧酸(含有氧元素的酸)酸性强弱的一条经验规律是:含氧酸分子的结构中含非羟基(羟基为﹣OH)氧原子数越多,该含氧酸的酸性越强;
(2)根据价层电子对互斥理论确定其空间构型,价层电子对个数=σ键个数+孤电子对个数,据此分析解答;
(3)根据氢键对物理性质的影响分析;
(4)对于ABn型分子,A原子的最外层电子,若完全成键,属于非极性分子,若不完全成键,则属于极性分子,据此分析;
(5)根据杂化轨道数判断杂化类型,杂化轨道数=δ键数+孤对电子对数;
(6)根据氯化铁的性质进行判断;
(7)配离子[TiCl(H2O)5]2+中Cl﹣、H2O含有孤对电子对是配体,根据离子电荷判断中心离子Tin+的电荷.
解答: 解:(1)含氧酸分子的结构中含非羟基(羟基为﹣OH)氧原子数越多,该含氧酸的酸性越强,所以含氧酸的通式可写成(HO)mROn,如果成酸元素R相同,则n值越大,酸性越强,酸性由强到弱:HClO3<HClO4,故答案为:<;
(2)H2O中心原子O原子成2个σ键、含有2对孤对电子,价层电子对个数=σ键个数+孤电子对个数=2+2=4,杂化轨道数为4,采取sp3杂化,H2O的VSEPR构型是正四面体;
H3O+的中心原子O价层电子对个数=3 =4,采取sp3杂化,有一对孤电子对,分子构型为三角锥型,故答案为:正四面体;三角锥;
=4,采取sp3杂化,有一对孤电子对,分子构型为三角锥型,故答案为:正四面体;三角锥;
(3)邻羟基苯甲醛能形成分子内氢键,对羟基苯甲醛能形成分子间氢键,所以邻羟基苯甲醛的熔点低于对羟基苯甲醛,故答案为:<;
(4):①NH3中元素化合价为﹣3,N原子最外层5个电子未全部成键,为极性分子;
②BF3中B元素化合价为+3,B原子最外层3个电子全部成键,为非极性分子;
③HCl中Cl元素化合价为+1,Cl原子最外层7个电子全部成键,为极性分子;
④SO3中S元素化合价为+6,S原子最外层6个电子全部成键,为非极性分子;
故答案为:②④;
(5)①苯中碳原子成1个C﹣Hδ键,2个C﹣Cδ键,同时参与成大π键,杂化轨道数为1+2=3,所以碳原子采取sp2杂化;
②CH3OH分子中中心原子C价电子对数=4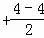 =4,采取sp3杂化;
=4,采取sp3杂化;
③HCHO分子中中心原子C价电子对数=3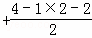 =3,采取sp2杂化;
=3,采取sp2杂化;
④CS2分子中中心原子C价电子对数=2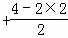 =2,采取sp杂化;
=2,采取sp杂化;
⑤CCl4分子中中心原子C价电子对数=4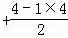 =4,采取sp3杂化;
=4,采取sp3杂化;
故答案为:①③;
(6)由题目信息可知,氯化铁的熔沸点低,易升华,所以氯化铁为分子晶体,故答案为:分子晶体;
(7)配离子[TiCl(H2O)5]2+的中心离子所带的电荷2+1=3,故中心离子为Ti3+,Cl﹣、H2O含有孤对电子对是配体,配位数是6,故答案为:Ti3+;6.
点评: 本题考查了杂化轨道、氢键、晶体类型的判断等,难度中等,注意基础知识的掌握与规律的总结.


科目:高中化学 来源: 题型:
短周期元素X、Y、Z、W的原子序数依次增大,它们的原子最外层电子数为互不相等的奇数,且X、Y、W原子最外层电子数之和恰好等于Z元素的核电荷数,X与W的最高化合价之和为8,常见金属元素Z的一种核素的质量数为28,中子数比质子数多2。下列说法中正确的是 ( )。
A.用“百度”搜索知,Y、Z形成的化合物“室温下强度高,……。导热性好,热膨胀系数小,是良好的耐热冲击材料。”由此可推测该化合物属于离子晶体
B.化合物YW3水解产物之一具有强氧化性,由此可知Y在该化合物中的化合价为+3价
C.由非金属元素组成的化合物YX5是一种是否存在尚待确证的化合物,假如存在,该物质与水反应必然生成气体X2,同时得到一种弱碱溶液
D.因为Z的氧化物熔点很高,不适宜于电解,故工业上常用电解Z与W的化合物的方法制取单质Z
查看答案和解析>>
科目:高中化学 来源: 题型:
下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是()
①H2O ②NH3 ③F﹣ ④CN﹣ ⑤CO.
A. ①② B. ①②③ C. ①②④ D. ①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下面的排序不正确的是()
A. 晶体熔点由低到高:CH4<SiH4<GeH4<SnH4
B. 熔点由高到低:Rb>K>Na
C. 硬度由大到小:金刚石>碳化硅>晶体硅
D. 晶格能由大到小:NaF>NaCl>NaBr>NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验事实能用同一原理解释的是( )
|
| A. | SO2和Cl2均能使溴水褪色 |
|
| B. | NH4Cl晶体、固态碘受热时均能变成气体 |
|
| C. | 福尔马林、葡萄糖与新制的Cu(OH)2共热均有红色沉淀生成 |
|
| D. | 苯酚、乙烯均能使溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于生物体内氨基酸的叙述错误的是 ( )。
A.构成蛋白质的氨基酸分子的结构通式是
B.人体内氨基酸的分解代谢最终产物是水、二氧化碳和尿素
C.人体内所有氨基酸均可以互相转化
D.两分子氨基酸通过脱水缩合可以形成二肽
查看答案和解析>>
科目:高中化学 来源: 题型:
利用如图所示装置进行下列实验,能得出相应实验结论的是( )
| 选 项 | ① | ② | ③ | 实验结论 |
|
| A. | 稀 硫 酸 | Na2S | AgNO3与 AgCl的 浊液 | Ksp(AgCl)> Ksp(Ag2S) | |
| B. | 浓 硫 酸 | 蔗糖 | 溴水 | 浓硫酸具有脱 水性、氧化性 | |
| C. | 稀 盐 酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性 钡盐均可生成 白色沉淀 | |
| D. | 浓 硝 酸 | Na2CO3 | Na2SiO3 溶液 | 酸性:硝酸> 碳酸>硅酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com