


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
| A、氯化铝溶液中加入过量氨水:Al3++4NH3?H2O═AlO2-+4NH4++2H2O |
| B、碳酸氢钙和盐酸反应HCO3-+H+═CO2↑+H2O |
| C、过量氢氧化钙与碳酸氢钠溶液反应Ca2++2HCO3-+2OH-═CaCO3↓+2H2O+CO32- |
| D、Fe3O4溶于稀硫酸:Fe3O4+8H+═3Fe3++4H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应.
A、B、C、D、E、F六种物质的相互转化关系如图所示(反应条件未标出),其中反应①是置换反应.查看答案和解析>>
科目:高中化学 来源: 题型:
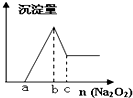 有一透明溶液,可能含有下列离子中的一种或几种,Al3+、Cu2+、Na+、H+、
有一透明溶液,可能含有下列离子中的一种或几种,Al3+、Cu2+、Na+、H+、查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解NaOH溶液时,溶液浓度将减小,pH增大 |
| B、电解H2SO4溶液时,溶液浓度将增大,pH减小 |
| C、电解Na2SO4溶液时,溶液浓度将增大,pH变大 |
| D、电解NaCl溶液时,溶液浓度将减小,pH不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(NH4+)>c(Cl-)>c(H+)>c(OH-) |
| B、c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| C、c(Cl-)>c(NH4+)>c(H+)>c(OH-) |
| D、c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Zn+2HCl═ZnCl2+H2↑ | ||||
| B、FeS+2HCl═FeCl2+H2S↑ | ||||
| C、NH3+HCl═NH4Cl | ||||
D、MnO2+4HCl
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com