
【题目】化合物A(C9H12O)是一种芳香醇,它不能被Cu催化氧化,可用于医药及香料的合成。A有如下转化关系。请回答下列问题。

已知:
①
②R1COCH3+R2CHO![]() R1COCH=CHR2+H2O
R1COCH=CHR2+H2O
(1)A的结构简式为________。
(2)B→D与H→I的反应类型分别为_____、______。
(3)F中的含氧官能团有_______。(写名称)
(4)若J为含有3个六元环的酯,则H→J反应的化学方程式为__________。
(5)下列关于物质K的说法正确的是(______)
A.K的化学式为C14H12O
B.能使酸性高锰酸钾溶液褪色
C.1mol的K与H2完全加成需要7mol的H2
D.K分子中所有原子可能在同一平面上
(6)H的同分异构体中,符合下列要求的同分异构体有______种。
①能与FeCl3溶液发生显色反应,且能与NaHCO3溶液反应;
②核磁共振氯谱显示有4种不同化学环境的氢,峰面积比为1:1:2:6。
(7)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成线路,设计一条由叔丁基氯(C(CH3)3Cl)和糠醛(
)是一种重要的医药中间体,请参考上述合成线路,设计一条由叔丁基氯(C(CH3)3Cl)和糠醛(![]() )为原料制备糠叉丙酮的合成线路(无机试剂任选)。__________
)为原料制备糠叉丙酮的合成线路(无机试剂任选)。__________
【答案】  加成反应 缩聚反应 醛基、羟基
加成反应 缩聚反应 醛基、羟基 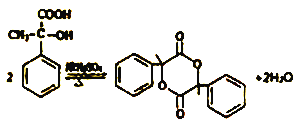 BD 2
BD 2 
【解析】化合物A(C9H12O)是一种芳香醇,它不能被Cu催化氧化, 则A为 ;根据B可与溴发生加成反应,故A转化为B应该是发生消去反应生成的B为
;根据B可与溴发生加成反应,故A转化为B应该是发生消去反应生成的B为 ;根据已知①
;根据已知① ,
, 被酸性高锰酸钾氧化生成C为
被酸性高锰酸钾氧化生成C为 ;根据已知②R1COCH3+R2CHO
;根据已知②R1COCH3+R2CHO![]() R1COCH=CHR2+H2O,
R1COCH=CHR2+H2O, 与苯甲醛在一定条件下反应生成K为
与苯甲醛在一定条件下反应生成K为 ;
; 与溴发生加成反应生成D为
与溴发生加成反应生成D为 ,
, 发生水解反应生成E为
发生水解反应生成E为 ;根据的分子式可知F比E少2个氢,则
;根据的分子式可知F比E少2个氢,则 氧化生成F为
氧化生成F为 ,
, 在银氨溶液中反应后酸化得到H为
在银氨溶液中反应后酸化得到H为 ,
, 在催化剂的作用下发生缩聚反应生成聚酯I为
在催化剂的作用下发生缩聚反应生成聚酯I为 。(1)A的结构简式为
。(1)A的结构简式为 ;(2)B→D是
;(2)B→D是 与溴发生加成反应生成
与溴发生加成反应生成 ,反应类型是加成反应;H→I是
,反应类型是加成反应;H→I是 在催化剂的作用下发生缩聚反应生成聚酯
在催化剂的作用下发生缩聚反应生成聚酯 ,反应类型是缩聚反应缩聚反应;(3)F为
,反应类型是缩聚反应缩聚反应;(3)F为 ,含氧官能团有醛基、羟基;(4)若J为含有3个六元环的酯,则为两分子H发生分子间酯化而得,为
,含氧官能团有醛基、羟基;(4)若J为含有3个六元环的酯,则为两分子H发生分子间酯化而得,为 ,H→J反应的化学方程式为
,H→J反应的化学方程式为 ;(5)K为
;(5)K为 。A.K的化学式为C15H10O,选项A错误;B.分子中含有碳碳双键,能使酸性高锰酸钾溶液褪色,选项B正确;C.1mol的K与H2完全加成需要8mol的H2,选项C错误;D.根据苯分子中12原子共面、乙烯6原子共面、甲醛4原子共面的情况,K分子中所有原子可能在同一平面上,选项D正确。答案选BD;(6)H(
。A.K的化学式为C15H10O,选项A错误;B.分子中含有碳碳双键,能使酸性高锰酸钾溶液褪色,选项B正确;C.1mol的K与H2完全加成需要8mol的H2,选项C错误;D.根据苯分子中12原子共面、乙烯6原子共面、甲醛4原子共面的情况,K分子中所有原子可能在同一平面上,选项D正确。答案选BD;(6)H( )的同分异构体,符合:①能与FeCl3溶液发生显色反应,且能与NaHCO3溶液反应,则含有酚羟基和羧基;②核磁共振氯谱显示有4种不同化学环境的氢,峰面积比为1:1:2:6,则有两个甲基且在对称位上,符合条件的同分异构体有
)的同分异构体,符合:①能与FeCl3溶液发生显色反应,且能与NaHCO3溶液反应,则含有酚羟基和羧基;②核磁共振氯谱显示有4种不同化学环境的氢,峰面积比为1:1:2:6,则有两个甲基且在对称位上,符合条件的同分异构体有 、
、 共2种;(7)叔丁基氯(C(CH3)3Cl)在氢氧化钠的乙醇溶液中加热发生消去反应生成2-甲基-1-丙烯,2-甲基-1-丙烯被酸性高锰酸钾氧化生成丙酮,丙酮与糠醛(
共2种;(7)叔丁基氯(C(CH3)3Cl)在氢氧化钠的乙醇溶液中加热发生消去反应生成2-甲基-1-丙烯,2-甲基-1-丙烯被酸性高锰酸钾氧化生成丙酮,丙酮与糠醛(![]() )反应生成糠叉丙酮(
)反应生成糠叉丙酮(![]() ),合成线路如下:
),合成线路如下: 。
。


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】在0.1mol·L-1NH3·H2O 溶液中有如下电离平衡:NH3·H2O ![]() NH4++OH- 对于该平衡,下列叙述正确的是
NH4++OH- 对于该平衡,下列叙述正确的是
A.加入水时,平衡向逆反应方向移动
B.加入少量NaOH固体,平衡向逆反应方向移动
C.加入少量 0.1 mol·L-1盐酸,溶液中c(H+)减小
D.加入少量NH4Cl固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体单质A和气体单质B在容积一定的密闭容器中完全反应生成气体C,同温下测得容器内压强不变,且反应后气体C的密度是原气体密度的4倍.则下列判断正确的是( )
A.两种单质的摩尔质量比为1:4
B.生成物C中A的质量分数为75%
C.生成物C中A,B的原子个数比为3:1
D.反应前后气体分子数比为1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的固定和利用对降低温室气体排放具有重要作用,CO2加氢合成甲醇不仅可以有效缓解减排压力,而且还是CO2综合利用的一条新途径。CO2和H2在催化剂作用下能发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。测得甲醇的理论产率与反应温度、压强的关系如图所示。
CH3OH(g)+H2O(g)。测得甲醇的理论产率与反应温度、压强的关系如图所示。

(1)下列措施能使CO2的转化率提高的是__。
A. 增大压强 B.升高温度 C.增大投料比 D.加入更高效的催化剂
(2)在220℃、5.0MPa时,CO2、H2的转化率之比为______。
(3)将温度从220℃降低至160℃,压强从5.0MPa减小至3.0MPa,化学反应速率将___(填“增大”“减小”或“不变”,下同),CO2的转化率将____。
(4)200℃时,将0.100 mol CO2和0.275 mol H2充入1 L密闭容器中,在催化剂作用下反应达到平衡。若CO2的转化率为25%,则此温度下该反应的平衡常数K=___ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化碳又称氧硫化碳(化学式为COS),是农药、医药和其它有机合成的重要原料。COS的合成方法之一是在无溶剂的条件下用CO与硫蒸气反应制得,该法流程简单、收效高,但含有CO2、SO2等杂质。
(1)COS的电子式为_________。
(2)已知CO2催化加氢合成乙醇的反应原理是: 2CO2(g)+6H2(g)![]() C2H5OH+3H2O(g) △H=-173.6kJ/mol
C2H5OH+3H2O(g) △H=-173.6kJ/mol
下图是不同起始投料时,CO2的平衡转化率随温度变化的关系,图中m=![]() ,为起始时的投料比,则m1、m2、m3从大到小的顺序为_______,理由是____________。
,为起始时的投料比,则m1、m2、m3从大到小的顺序为_______,理由是____________。

(3)天然气部分氧化制取的化工原料气中,常含有COS。目前COS水解是脱除COS的常见方法,即COS在催化剂作用下与水蒸气反应生成硫化氢,生成的硫化氢可用氧化锌等脱硫剂脱除。
①COS水解的化学方程式为_________________。
②常温下,实验测得脱硫(脱除硫化氢)反应过程中,每消耗4.05gZnO,放出3.83kJ热量。该脱硫反应的热化学方程式为_________________。
③近年来,电化学间接氧化法处理硫化氢的技术得到较快发展。该方法是利用Fe3+在酸性条件下与H2S反应生成硫单质,反应后的溶液再用电解的方法“再生”,实现循环利用。电解法使Fe3+“再生”的离子方程式为___________,该反应的阳极材料是______。
④常温下,HCl和CuCl2的混合溶液中,c(H+)=0.30mol/L,c(Cu2+)=0.10mol/L,往该溶液中通入H2S至饱和(H2S的近似浓度为0.10mol/L),_____(填“能”或“不能”)出现沉淀,用必要的计算过程和文字说明理由。
(已知Ka1(H2S)=1.3×10-7,Ka2(H2S)=7.0×10-5,Ksp(CuS)=1.4×10-36)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 铝粉投入到NaOH溶液中:2Al+2OH-+2H2O══ 2AlO2—+3H2↑
B. AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C. 三氯化铁溶液中加入铁粉![]()
D. FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用氧化还原滴定法测定某种草酸晶体(H2C2O4·X H2O)中结晶水分子数的实验步骤如下:
①用分析天平称取草酸晶体1.260g,将其配制成100.00mL待测草酸溶液;
②用移液管移取25.00mL待测草酸溶液于锥形瓶中,并加入适量硫酸酸化
③用浓度为0.1000 mol/L的KMnO4标准溶液进行滴定,三次结果如下:
第一次滴定 | 第二次滴定 | 第三次滴定 | |
待测溶液体积(mL) | 25.00 | 25.00 | 25.00 |
标准溶液体积(mL) | 9.99 | 10.01 | 10.00 |
已知:H2C2O4的相对分子质量为90。
回答下列问题:
(1)滴定时,KMnO4标准溶液应该装在_____ (填“酸式”或“碱式”)滴定管中。
(2)H2C2O4在溶液中与KMnO4溶液反应的化学方程式是______________
(3)到达滴定终点的标志是____________。
(4)根据上述数据计算X=________________。
(5)误差分析(填:偏高、偏低、无影响):
①若滴定开始时仰视滴定管刻度,滴定结束时俯视滴定管刻度,则X值_________;
②若滴定管水洗后直接加入KMnO4标准溶液,则X值_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置或操作能达到实验目的(必要的夹持装置及石棉网已省略)的是

A. 实验室制乙烯
B. 实验室制乙炔并验证乙炔能发生氧化反应
C. 实验室中分馏石油
D. 若甲为硫酸,乙为贝壳(粉状),丙为苯酚钠溶液,验证硫酸、碳酸、苯酚酸性的强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知95 ℃时水的离子积KW=1×10-12,25 ℃时KW=1×10-14,回答下列问题:
(1)95 ℃时水的电离常数K(95 ℃)________25 ℃时水的电离常数(填“>”、“=”或“<”)。
(2)95 ℃纯水中c(H+)________c(OH-)。(填“>”、“=”或“<”)
(3)95 ℃时向纯水中加入NaOH,c(OH-)=1×10-1 mol/L,此时pH=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com