
| A. | 氢气通过灼热的CuO粉末 | B. | 碳与SiO2高温反应制粗硅 | ||
| C. | 将锌粒投入Cu(NO3)2溶液 | D. | 镁条在CO2中燃烧 |
分析 A.氢气还原CuO生成Cu和水;
B.C与二氧化硅反应生成Si和CO;
C.Zn与硝酸铜反应生成硝酸锌和Cu;
D.Mg与二氧化碳反应生成MgO和C.
解答 解:A.氢气还原CuO生成Cu和水,则反应前后固体质量减少为氧元素的质量,故A不选;
B.C与二氧化硅反应生成Si和CO,则反应前后固体质量减少为氧元素的质量,故B不选;
C.Zn与硝酸铜反应生成硝酸锌和Cu,则反应前后固体质量减少为等物质的量Zn、Cu的质量差,故C不选;
D.Mg与二氧化碳反应生成MgO和C,则反应前后固体增加的质量为二氧化碳的质量,故D选;
故选D.
点评 本题考查金属及化合物的性质,为高频考点,把握发生的反应及反应前后固体的判断为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:填空题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 开始沉淀的pH | 完全沉淀的pH | |
| Fe(OH)2 | 7.0 | 9.0 |
| Fe(OH)3 | 1.9 | 3.2 |
| Cr(OH)3 | 6.0 | 8.0 |
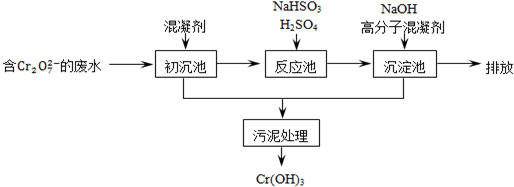
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
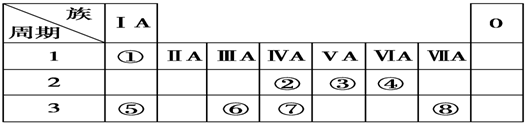
| 元素代号 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(nm) | 0.186 | 0.160 | 0.037 | 0.143 | 0.110 | 0.099 | 0.075 | 0.074 |
| 主要化合价 | +1 | +2 | +1 | +3 | +5、-3 | +7、-1 | +5、-3 | -2 |
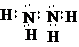
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
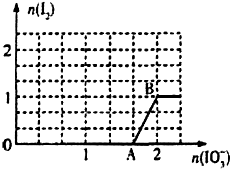 已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .②的最高价氧化物的电子式是:
.②的最高价氧化物的电子式是:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com