
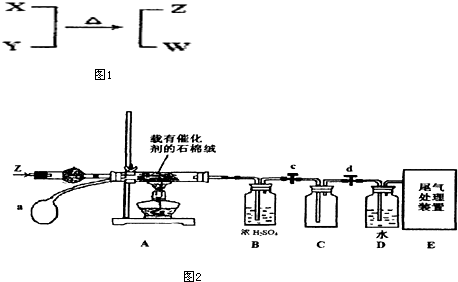
分析 X、Y、Z、W为电子数相同的分子或离子,X有5个原子核,通常状况下,W为无色液体,发生反应X+Y$\stackrel{△}{→}$Z+W,应是NH4++OH-=NH3↑+H2O,推断X为NH4+、Y为OH-、Z为NH3、W为H2O.
(1)实验室用氢氧化钙与氯化铵再加热条件下制备氨气,反应生成氯化钙、氨气与水;
(2)①A中发生氨的催化氧化,氨气与氧气反应生成NO与水;
②吸收水与未反应的氨气;
(3)D中为二氧化氮与水反应生成硝酸与NO;
(4)ag HNO3的稀溶液中,加入bg铁粉充分反应,铁粉全部溶解,硝酸与Fe的物质的量比为$\frac{\frac{a}{63}}{\frac{b}{56}}$=$\frac{a}{b}$×$\frac{8}{9}$,已知3≤$\frac{a}{b}$≤4.5,则硝酸与铁的物质的量比为x,8:3≤x≤4:1,则产生中亚铁离子、铁离子均存在,发生4HNO3+Fe=Fe(NO3)3+NO↑+2H2O、8HNO3+3Fe=3Fe(NO3)2+2NO↑+4H2O,结合反应计算.
解答 解:X、Y、Z、W为电子数相同的分子或离子,X有5个原子核,通常状况下,W为无色液体,发生反应X+Y$\stackrel{△}{→}$Z+W,应是NH4++OH-=NH3↑+H2O,推断X为NH4+、Y为OH-、Z为NH3、W为H2O.
(1)实验室用氢氧化钙与氯化铵再加热条件下制备氨气,反应生成氯化钙、氨气与水,反应方程式为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+CaCl2,
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+CaCl2;
(2)①A中发生氨的催化氧化,氨气与氧气反应生成NO与水,反应方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O,
故答案为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
②浓硫酸作用是吸收水与未反应的氨气,
故答案为:吸收水与未反应的氨气;
(3)D中为二氧化氮与水反应生成硝酸与NO,反应方程式为3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
(4)ag HNO3的稀溶液中,加入bg铁粉充分反应,铁粉全部溶解,硝酸与Fe的物质的量比为$\frac{\frac{a}{63}}{\frac{b}{56}}$=$\frac{a}{b}$×$\frac{8}{9}$,已知3≤$\frac{a}{b}$≤4.5,则硝酸与铁的物质的量比为x,8:3≤x≤4:1,则产生中亚铁离子、铁离子均存在,设分别为mmol、nmol,则
4HNO3+Fe=Fe(NO3)3+NO↑+2H2O
4m m m
8HNO3+3Fe=3Fe(NO3)2+2NO↑+4H2O
$\frac{8}{3}$n n $\frac{2}{3}$n
则$\left\{\begin{array}{l}{m+n=\frac{b}{56}}\\{4m+\frac{8}{3}n=\frac{a}{63}}\end{array}\right.$,解得n=$\frac{3b}{56}$-$\frac{a}{84}$,m=$\frac{a}{84}$-$\frac{2b}{56}$,
由N原子守恒可知,被还原的硝酸为(m+$\frac{2}{3}$n)mol×63g/mol=$\frac{a}{4}$g,
故答案为:$\frac{a}{4}$.
点评 本题考查无机物推断、硝酸的制备、化学计算等,题目比较综合,推断物质是解题关键,注意识记常见10电子、18电子微粒,难度较大.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
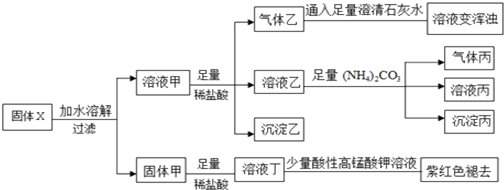
| A. | 气体乙和气体丙都为纯净物 | |
| B. | 固体粉末X中一定含有FeO、Na2S2O3、NaAlO2、Na2CO3,可能含有NaHCO3 | |
| C. | 溶液丁中的阳离子可能只含H+、Fe2+ | |
| D. | 溶液甲中一定含有AlO2-、CO32-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | A | B | C |
| 装置 | 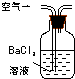 | 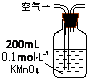 | 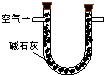 |
| 原理 | 通入V升空气,测定生成沉淀的质量 | 当KMnO4溶液刚好褪色时,测定通入空气的体积V | 通入V升空气,测定U型管增加的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 标准状况下,22.4LSO3含有NA个SO3分子 | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为4NA | |
| D. | 56g铁片投入足量浓H2SO4中生成NA个SO2分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ③ | C. | ①②③ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质$\left\{\begin{array}{l}{混合物}\\{纯净物\left\{\begin{array}{l}{溶液}\\{化合物}\end{array}\right.}\end{array}\right.$ | |
| B. | 纯净物$\left\{\begin{array}{l}{单质\left\{\begin{array}{l}{金属单质}\\{非金属单质}\end{array}\right.}\\{化合物}\end{array}\right.$ | |
| C. | 化合物$\left\{\begin{array}{l}{有机物}\\{无机物\left\{\begin{array}{l}{酸\left\{\begin{array}{l}{氧化物}\\{非氧化物}\end{array}\right.}\\{碱}\\{盐}\end{array}\right.}\end{array}\right.$ | |
| D. | 纯净物$\left\{\begin{array}{l}{无机物\left\{\begin{array}{l}{单质}\\{氧化物}\\{化合物}\end{array}\right.}\\{有机物}\end{array}\right.$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.06mol/L | B. | 0.12mol/L | C. | 0.03mol/L | D. | 0.24mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.7 g | B. | 5.4 g | C. | 6.75 g | D. | 8.1 g |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com