
【题目】在一固定容积的密闭容器中,进行如下反应:C(s)+H2O(g) ![]() CO(g)+H2(g)
CO(g)+H2(g)
(1)若容器体积为2L,反应l0s氢气质量增加0.4g,则该时间内一氧化碳的反应速率为_______mol/(L.s)。若增加炭的量,则正反应速率_______。(选填“增大”、“减小”、不变)若增大压强,化学平衡向____移动。(选填“正向”、“逆向”或“不”)
(2)该反应达到平衡状态的标志是______。(选填编号)
A.压强不变 B.v正(H2)=V正(H2O) C.c(CO)不变 D.c(H2O)=c(CO)
(3)若升高温度,平衡向正向移动,则正反应是_______反应。(选填“吸热”或“放热”)
【答案】 0.01 不变 逆向 AC 吸热
【解析】考查化学反应速率的计算、影响化学反应速率因素、勒夏特列原理、化学平衡状态的判断,(1)氢气的质量增加0.4g,即生成氢气的物质的量为0.4/2mol=0.2mol,生成CO的物质的量为0.2mol,根据化学反应速率的数学表达式,v(CO)=0.2/(2×10)mol/(L·s)=0.01mol/(L·s),因为C是固体,浓度视为常数,即增加炭的量,化学反应速率不变;C为固体,反应前气体系数之和小于反应后气体系数之和,增大压强,平衡向逆反应方向移动;(2)A、C为固体,反应前后气体系数之和不相等,因此当压强不再改变,说明反应达到平衡,故A正确;B、两个反应都是向正反应方向进行,因此不能说明反应达到平衡,故B错误;C、根据化学平衡状态的定义,在一定条件下,组分浓度不再改变,说明反应达到平衡,故C正确;D、没有给出起始的量,因此无法判断是否达到平衡,故D错误;(3)升高温度,平衡向正反应方向进行,根据勒夏特列原理,正反应为吸热反应。


科目:高中化学 来源: 题型:
【题目】下列关于实验操作的叙述中正确的是( )
A. 从试剂瓶中取出任何药品,若有剩余一定不能再放回原试剂瓶中
B. 可燃性气体点燃之前必须验纯
C. 用胶头滴管向试管中滴加液体,一定要将滴管伸入试管内
D. 用温度计搅拌溶液一定要慢慢搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】40℃时,在氨-水体系中不断通入CO2,各种离子的变化趋势如图所示.下列说法不正确的是( )
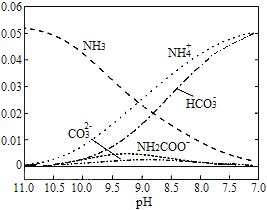
A. 在pH=9.0时,c(NH4+)>c(HCO3-)>c(NH2COO-)>c(CO32-)
B. 不同pH的溶液中存在关系:c(NH4+)+c(H+)=2c(CO32-)+c(HCO3-)+c(NH2COO-)+c(OH-)
C. 随着CO2的通入,![]() 不断增大
不断增大
D. 在溶液pH不断降低的过程中,有含NH2COO-的中间产物生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨主要用于生产化肥和硝酸。“十三五”期间,预计我国合成氨产量将保持稳中略增。
(1)目前工业上用氮气和氢气合成氨的生产条件为_________。
(2)下图是不同温度和不同压强下,反应达到平衡后,混合物中NH3含量(体积%)的变化情况,己知初始时n(N2):n(H2)=1:3。由图可知,合成氨的反应是______反应(选填“吸热”、“放热”);判断pl、p2压强的大小关系,pl_______p2 (选填“>”、 “<”或“=”)。
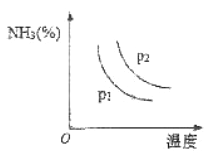
(3)草木灰主要含有碳酸钾,解释草木灰不宜与铵态氮肥混合使用的原因_____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是一种重要的工业原料。工业上利用反应3Cl2+2NH3===N2+6HCl检查氯气管道是否漏气。下列说法错误的是( )
A. 若管道漏气遇氨就会产生白烟 B. 该反应利用了Cl2的强氧化性
C. 该反应属于复分解反应 D. 生成1 mol N2有6 mol电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5 mol H2O的质量为 ____,其中含有_____个水分子,共有____个原子。
(2)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是______,在相同温度和相同压强条件下,体积最大的是______,体积最小的是________。
(3)在_______mL 0.2 mol/L NaOH溶液中含1 g溶质;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O _________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图示及描述,回答下列问题:

(1)关闭图A装置中的止水夹a后,从长颈漏斗向试管口注入一定量的水,静置后如图所示。试判断:A装置是否漏气?____________(填“漏气”、“不漏气”或“无法确定”),判断理由_____________。
(2)关闭图B装置中的止水夹a后,开启活塞b,水不断往下滴,直至全部流入烧瓶。试判断:B装置是否漏气?___________(填“漏气”、“不漏气”或“无法确定”),判断理由____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜锈的主要成分是碱式碳酸铜。碱式碳酸铜受热分解的化学方程式为: Cu2(OH)2CO3![]() 2CuO+X+CO2↑。下列说法正确的是
2CuO+X+CO2↑。下列说法正确的是
A. 反应前后固体物质中铜元素的质量分数不变
B. 碱式碳酸铜中铜原子和氧原子的质量比为 8:5
C. X 是相对分子质量最小的氧化物
D. 加热 Cu2(OH)2CO3 的实验装置和实验室用双氧水制取 O2 的发生装置相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com