
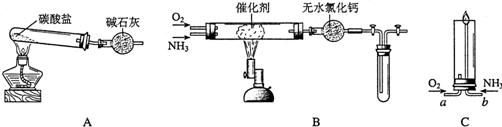
分析 碳酸铵或者碳酸氢铵不稳定受热分解生成氨气、二氧化碳和水,用碱石灰吸收二氧化碳和水剩余气体为氨气,氨气催化氧化生成一氧化氮和水.
(1)铵盐不稳定,受热分解产生氨气,根据装置图可知是用碳酸盐反应制取氨气;碳酸铵者或碳酸氢铵不稳定受热分解生成氨气、二氧化碳和水,用碱石灰吸收二氧化碳和水剩余气体为氨气;
(2)氨气催化氧化生成一氧化氮和水,依据氧化还原反应得失电子守恒、原子个数守恒配平书写方程式;
(3)NH3在空气中不能点燃,NH3逸出会造成污染,所以应该先通入氧气,氨气在氧气中燃烧生成氮气和水.
解答 解:(1)铵盐不稳定,受热分解产生氨气,根据装置图可知是用碳酸盐反应制取氨气,则应该是碳酸铵或碳酸氢铵,所以用装置A制取纯净、干燥的氨气,大试管内碳酸盐的化学式是(NH4)2CO3或NH4HCO3;(NH4)2CO3或NH4HCO3加热发生分解反应产生氨气、二氧化碳和水蒸气,要证明氨气可以燃烧,要将混合气体中的二氧化碳和水蒸气除去,但不能与氨气发生反应,利用碱石灰就可以吸收CO2和H2O,得到纯净的NH3;
故答案为:(NH4)2CO3或NH4HCO3; 吸收CO2和H2O,得到纯净的NH3;
(2)将产生的氨气与过量的氧气通到装置B(催化剂为铂石棉)中,用酒精喷灯加热:氨在催化剂存在时被氧化产生NO和水,根据电子守恒及原子守恒,可得氨气催化氧化的化学方程式是4NH3+5O2$?_{△}^{催化剂}$4NO+6H2O;
故答案为:4NH3+5O2$?_{△}^{催化剂}$4NO+6H2O;
(3)①将过量的氧气与A产生的氨气分别从a、b两管进气口通入到装置C中,并在b管上端点燃氨气,①由于氨气可以在纯净的氧气中安静的燃烧,所以应该先通入氧气,把装置中的空气赶出;然后再通入氨气;先通入氧气,后通入氨气的理由是若先通入NH3,NH3在空气中不能点燃,NH3逸出会造成污染;
故答案为:先通入O2,后通入NH3;若先通入NH3,NH3在空气中不能点燃,NH3逸出会造成污染;
②氨气在氧气中燃烧,反应产生氮气和水,反应的化学方程式是4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O,故答案为:4NH3+3O2$\frac{\underline{\;点燃\;}}{\;}$2N2+6H2O.
点评 本题考查了氨气的实验室制备和性质检验,明确实验室制备氨气原理、熟悉铵盐、氨气的性质即可解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
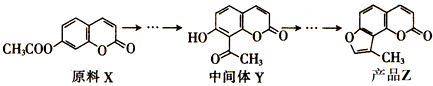
| A. | X与Y互为同分异构体 | |
| B. | X与Y均不能使酸性KMnO4溶液褪色 | |
| C. | 在光照条件下,Z中的苯环能与Cl2发生取代反应 | |
| D. | Z中所有不饱和键均能与溴发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
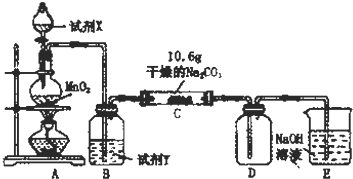
| 实验步骤 | 预期现象和结论 |
| 步骤1:取C中的少量固体样品于试管中,滴加足量蒸馏水 至固体溶解,然后将所得溶液分别置于A、B试管中. | |
| 步骤2:向A试管中滴加适量BaCl2溶液. | a.若无明显现象,证明固体中不含Na2CO3 b.若溶液变浑浊,证明固体中含Na2CO3 |
| 步骤3:向B试管中滴加过量的稀硝酸,再滴加AgNO3溶液 | 若溶液变浑浊,证明固体中含有NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
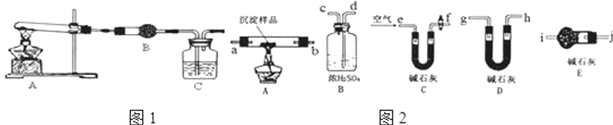
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 0.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
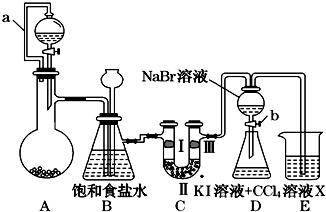
| ① | ② | ③ | ④ | |
| Ⅰ | 湿润的红纸条 | 干燥的红纸条 | 干燥的红纸条 | 湿润的红纸条 |
| Ⅱ | 碱石灰 | 浓硫酸 | 硅胶 | 氯化钠 |
| Ⅲ | 湿润的红纸条 | 干燥的红纸条 | 干燥的白纸条 | 干燥的红纸条 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
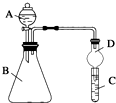 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com