
| A. | ①③⑤ | B. | ②④⑤ | C. | ③④ | D. | ④⑤ |
分析 ①氨水溶液中,浓度越大其密度越小,根据等质量两种不同质量分数的同种溶液混合时,溶质质量分数为:两种质量分数加起来除以2,如果不等质量混合,溶质质量分数就偏向于质量大的溶液的质量分数;
②根据C=$\frac{n}{V}$来分析误差,如果n偏大或V偏小都导致配制溶液浓度偏高;
③硫酸溶液中,浓度越大其密度越大,根据C=$\frac{n}{V}$来分析溶液浓度;
④硫酸的质量分数越大,溶质的密度越大,10%的硫酸和90%的硫酸等体积混合后溶质质量分数大于两溶液质量分数的平均值;
⑤根据溶剂质量不变,溶液质量由1g变为5g,质量分数变为原先的$\frac{1}{5}$.
解答 解:①5x%的氨水与x%的氨水等质量混合时溶质的质量分数为:$\frac{5x%+x%}{2}$=3x%,如果等体积混合时,由于5x%的氨水的密度小于x%的氨水的密度,则所以x%的氨水的质量大于5x%的氨水的质量,所以混合后溶质质量分数偏向于%的氨水,故质量分数小于3x%,故①错误;
②配制一定物质的量浓度的硫酸溶液时,定容后,塞好塞子倒转摇匀后,发现液面低于刻度线,溶质的物质的量和溶液的体积都不变,所以配制溶液浓度不变,故②错误;
③浓硫酸溶液密度大于水的密度,在80mL水中加入18.4mol/L的硫酸20mL,溶液体积小于100mL,所以配制浓度高于3.68mol/L,故③正确;
④硫酸的密度大于1,10%的硫酸和90%的硫酸等体积混合,所得溶液的质量分数大于50%,故正确;
⑤用1g 98%的浓硫酸加4g水,所得溶液中硫酸的质量分数为:$\frac{1g×98%}{1g+4g}$×100%=19.6%,该操作合理,质量分数不变,故⑤错误;
故选C.
点评 本题考查了配制一定浓度的溶液方法及误差分析的判断,题目难度中等,注意掌握配制一定浓度的溶液步骤,明确分析误差的方法与技巧,试题培养了学生灵活应用所学知识的能力.


科目:高中化学 来源: 题型:选择题
| A. | 除去CO2中的少量HCl:通入NaOH溶液,收集气体 | |
| B. | 除去H2中的少量HCl:通入Na2CO3溶液,收集气体 | |
| C. | 除去NaCl溶液中少量CaCl2:加入过量Na2CO3溶液,过滤 | |
| D. | 除去MgO中少量Al2O3:加入过量NaOH溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 1:2 | C. | 2:1 | D. | 任意比 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维导电能力很强,是一种很好的通讯材料 | |
| B. | 为了防止蛋白质盐析,疫苗等生物制剂应冷冻保藏 | |
| C. | 氯气泄漏时,应用浸有纯碱溶液的湿毛巾捂住口鼻向高处转移 | |
| D. | 用含有橙色酸性重铬酸钾的仪器检验酒后驾车,利用了乙醇的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
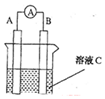 (1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为4H++2NO3-+2e-=2NO2↑+2H2O,A电极的电极反应式为Cu-2e-=Cu2+;反应进行一段时间后溶液C的pH将升高(填“升高”“降低”或“基本不变”).
(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe,A电极材料为Cu,则B电极的电极反应式为4H++2NO3-+2e-=2NO2↑+2H2O,A电极的电极反应式为Cu-2e-=Cu2+;反应进行一段时间后溶液C的pH将升高(填“升高”“降低”或“基本不变”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 在Na2S溶液中加入AgCl固体,溶液中c(S2-)减小 | |
| C. | N2(g)+3H2(g)=2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 | |
| D. | 水的离子积常数Kw随着温度的升高而增大,说明水的电离是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1HCl溶液与0.2 mol•L-1氨水等体积混合(pH>7):c(NH4+)>c(Cl-)>c(NH3•H2O)>c(OH-) | |
| B. | Na2CO3溶液中:c(Na+)<2c(CO32-)+c(HCO3-) | |
| C. | c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c(NH4Cl)>c[(NH4)2SO4] | |
| D. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液中:c(NH4+)+c(NH3•H2O)+c(Fe2+)=0.3 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com