
在熔融KOH中大气中的氧可将铬铁矿FeCr2O4中Fe和Cr的化合价都转化为+6价,氧化 1 mol FeCr2O4在理论上需要多少摩尔氧气
| A.2mol | B.2.5mol | C.3mol | D.4mol |
科目:高中化学 来源: 题型:单选题
(5分)已知盐酸参加的下列三个反应:
①CaCO3 + 2HCl ==CaCl2 + CO2↑ + H2O
②Fe + 2HCl ==FeCl2 + H2↑
③MnO2 + 4HCl(浓)  MnCl2 + Cl2↑ + 2H2O
MnCl2 + Cl2↑ + 2H2O
(1)判断上述三个反应中属于氧化还原反应的是_________,其中盐酸作还原剂的是__________。(2)上述反应说明盐酸具有_______性,______性,_______性。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在铜的催化作用下氨气与氟气反应,得到一种三角锥形分子M和一种铵盐Q。下列有关说法错误的是
| A.该反应的化学方程式为:4NH3 + 3F2 → NF3 + 3NH4F |
| B.M是极性分子,其还原性比NH3强 |
| C.M既是氧化产物,又是还原产物 |
| D.4moNH3参加反应失去12mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。下列对于过氧化钙(CaO2)的叙述错误的是
| A.CaO2具有氧化性,对面粉可能具有增白作用 |
| B.CaO2中阴阳离子的个数比为1:1 |
| C.CaO2和水反应时,每产生1 mol O2转移电子4 mol |
| D.CaO2和CO2反应的化学方程式为:2CaO2 +2CO2 =2CaCO3+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4,下列说法正确的是( )
| A.只有硫酸铜作氧化剂 |
| B.SO42-既不是氧化产物又不是还原产物 |
| C.被氧化的硫与被还原的硫的质量比为3:7 |
| D.1mol硫酸铜可以氧化5/7mol的硫 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有: HF、 NO 和 HNO3。则下列说法错误的是:( )
| A.反应过程中,被氧化与被还原的元素的物质的量之比为1 :2 |
| B.NF3是一种无色、无臭的气体,因此NF3在空气中泄漏时不易被察觉 |
| C.一旦NF3泄漏,可以用NaOH溶液喷淋的方法减少空气污染 |
| D.若反应中生成1.0mol NO,转移的电子数目为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氧化还原反应是重要的反应类型,下列有关说法正确的是
| A.1molAl和足量的NaOH溶液反应,失去的电子数为3NA(NA表示阿伏加德罗常数) |
| B.原电池的负极发生氧化反应,电解池的阳极发生还原反应 |
| C.Cu能被FeCl3溶液腐蚀,其离子方程式为:Cu+Fe3+=Cu2++Fe2+ |
| D.Na+、Ba2+、NO3-、SO32-四种离子在溶液中因发生氧化还原反应而不能大量共存 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
RO2受热分解为+4和+2价的混合氧化物,+4价的R能氧化浓盐酸生成Cl2,现将1mol RO2加热分解得到O2,再向残余固体中加入过量的浓盐酸得到Cl2,所得 O2和Cl2物质的量之比为3 : 2,则残余固体的组成及物质的量之比可能是
| A.R3O4,RO,2 :1 | B.RO2,RO, 1:3 |
| C.RO2,R3O4 ,1 : 2 | D.RO2,RO,1 : 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)某经济开发区将钛冶炼厂与氯碱厂、甲醇厂组成了一个产业链(如图所示),大大地提高了资源利用率,减少了环境污染。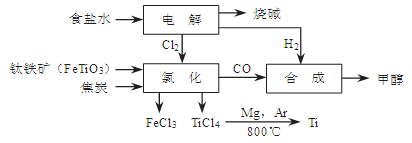
请填写下列空白:
(1)写出钛铁矿经氯化得到四氯化钛的化学方程式: 。
(2)由CO和H2合成甲醇是放热的,方程式是:CO(g)+2H2(g)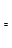 CH3OH(g)。
CH3OH(g)。
①已知该反应在300℃时的化学平衡常数为0.27,该温度下将2 mol CO、3 mol H2和2 mol CH3OH充入容积为2 L的密闭容器中,此时反应将 (填“向正反应方向进行”、“向逆反应方向进行”或“处于平衡状态”)。
②下图表示合成甲醇反应达到平衡后,每次只改变温度、压强、催化剂中的某一条件,反应速率υ与时间t的关系。其中表示平衡混合物中的甲醇的含量最高的一段时间是 。图中t3时改变的条件可能是 。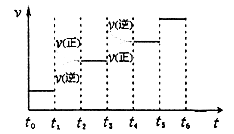
(3)某同学设计了一个甲醇燃料电池,并用该电池电解200mL—定浓度NaCl与CuSO4混合溶液,其装置如图: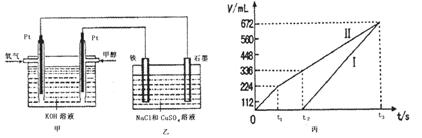
①写出甲中通入甲醇这一极的电极反应式 。
②理论上乙中两极所得气体的体积随时间变化的关系如丙图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 ,原混合溶液中NaCl的物质的量浓度为 mol/L。(假设溶液体积不变)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com