
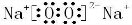 .
.分析 A、B、C、D、E五种主族元素的原子序数依次增大,且均小于18.B原子的质子数是其电子层数的4倍,B为O或Mg,而A原子的最外层电子比B原子的最外层电子少2个,故B只能为O,则A为碳;A、B、C三种元素能结合成化合物C2AB3,在1mol C2AB3中共有52mol电子,则C元素原子电子数=(52-6-24)÷2=11,则C为Na;D元素的单质0.5mol与酸全部反应时,有9.03×1023个即1.5mol电子转移,所以D元素的化合价为+3价,即D为Al;E元素的单质是一种黄绿色气体,水溶液具有漂白性,则E为Cl,据此解答.
解答 解:A、B、C、D、E五种主族元素的原子序数依次增大,且均小于18.B原子的质子数是其电子层数的4倍,B为O或Mg,而A原子的最外层电子比B原子的最外层电子少2个,故B只能为O,则A为碳;A、B、C三种元素能结合成化合物C2AB3,在1mol C2AB3中共有52mol电子,则C元素原子电子数=(52-6-24)÷2=11,则C为Na;D元素的单质0.5mol与酸全部反应时,有9.03×1023个即1.5mol电子转移,所以D元素的化合价为+3价,即D为Al;E元素的单质是一种黄绿色气体,水溶液具有漂白性,则E为Cl,.
(1)由上述分析可知,A为碳,E为氯,故答案为:碳;氯;
(2)B为氧元素,在周期表中的位置为第二周期ⅥA族,故答案为:ⅥA;
(3)由元素O、Na形成的一种化合物可以作为呼吸面具的供氧剂,该化合物为Na2O2,属于离子化合物,其电子式为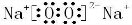 ,故答案为:离子;
,故答案为:离子;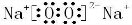 ;
;
(4)氢氧化钠与氢氧化铝反应生成偏铝酸钠与水,反应的离子方程式为:Al(OH)3+OH-=AlO2-+2H2O,故答案为:Al(OH)3+OH-=AlO2-+2H2O.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,难度不大,注意对基础知识的全面掌握.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
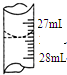 欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1的HCl标准溶液进行中和滴定(用甲基橙作指示剂).
欲测定某NaOH溶液的物质的量浓度,可用0.1000mol•L-1的HCl标准溶液进行中和滴定(用甲基橙作指示剂).| 实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol•L-1HCl溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 25.00 | 0.00 | 26.29 |
| 2 | 25.00 | 1.00 | 31.00 |
| 3 | 25.00 | 1.00 | 27.31 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
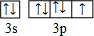 ,R基态原子的外围电子排布式为3d104s1.
,R基态原子的外围电子排布式为3d104s1.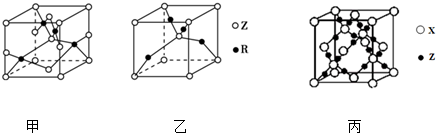
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、苯、环己烷属于脂肪烃 | B. | 苯、环己烷属于芳香烃 | ||
| C. | 乙烯、乙炔属于烯烃 | D. | 环戊烷、环己烷属于环烷烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
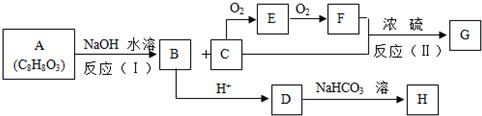
 ,E:HCHO,H:
,E:HCHO,H: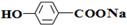 G:HCOOCH3,.
G:HCOOCH3,. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:Na>Mg>Ca | B. | 氧化性:Cl2>S>P | ||
| C. | 酸性:H2SO4>H3PO4>HClO4 | D. | 稳定性:PH3>H2S>HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com