
| A. | 阳极材料也可以是Cu | |
| B. | 阴极每产生3molH2,则有1mol Cr2O72-被还原 | |
| C. | 一段时间后溶液中发生反应Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O | |
| D. | 电解最后阶段需要加碱,使溶液中的阳离子转化为沉淀 |
分析 A.铁为电极,则阳极上铁失去电子生成二价铁具有还原性可以将Cr2O72-被还原生成Cr3+;
B.阴极每产生3molH2,则转移电子数6mol,根据氧化还原反应得失电子守恒得6Fe~12e-~6Fe2+~Cr2O72-,据此计算;
C.亚铁离子具有还原性,发生氧化还原反应;
D.阳离子向阴极移动,且阴极生成碱.
解答 解:A.铁为电极,则阳极上铁失去电子,则发生Fe-2e-=Fe2+,二价铁具有还原性可以将Cr2O72-被还原生成Cr3+,而铜作阳极生成铜离子无还原性,不能将Cr2O72-被还原生成Cr3+,故A错误;
B.阴极每产生3molH2,则转移电子数6mol,根据氧化还原反应得失电子守恒得6Fe~12e-~6Fe2+~Cr2O72-,故被还原的Cr2O72-的物质的量为0.5mol,故B错误;
C.电解时阳极生成的亚铁离子具有还原性,发生氧化还原反应,离子反应为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O,故C正确;
D.由C可知,反应中生成的阳离子向阴极移动,且阴极生成碱,则在阴极附近生成Cr(0H)3和Fe(0H)3沉淀,所以电解最后阶段不需要加碱,故D错误;
故选C.
点评 本题考查电解原理,明确电解过程中离子的移动及离子的放电顺序、发生的电极反应是解答本题的关键,题目难度中等.


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | N2、H2和NH3的质量分数不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | N2与H2的物质的量之和是NH3的物质的量2倍 | |
| D. | 单位时间里每增加1molN2,同时消耗2molNH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
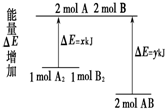
| A. | 因为该反应为放热反应,故不必加热反应就可发生 | |
| B. | 断裂1 mol A-A 键和1 mol B-B 键放出x kJ能量 | |
| C. | 断裂2 mol A-B 键需要吸收y kJ的能量 | |
| D. | 2 mol AB的总能量高于1 mol A2和1 mol B2的总能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
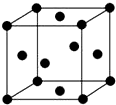 已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,E位于第四周期.A位于周期表中的s区,其原子中电子层数和未成对电子数相同;B的基态原子中的核外电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外电子总数是最内层电子总数的4倍.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,E位于第四周期.A位于周期表中的s区,其原子中电子层数和未成对电子数相同;B的基态原子中的核外电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外电子总数是最内层电子总数的4倍.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 ,肉桂醛分子结构中有6种不同化学环境的氢原子.
,肉桂醛分子结构中有6种不同化学环境的氢原子.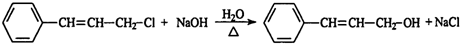 ,B转化为肉桂醛的反应条件为Cu/Ag加热.
,B转化为肉桂醛的反应条件为Cu/Ag加热. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 比例模型 :可以表示二氧化碳分子,也可以表示水分子 :可以表示二氧化碳分子,也可以表示水分子 | |
| B. | 室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合溶液的pH=5,则混合溶液中由水电离出的c(H+)=1×10-5mol/L | |
| C. | 纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于-183℃时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同位素 | |
| D. | 已知 Ag2CrO4的Ksp为1.12×10-12,则将等体积的1×10-4 mol•L-1的AgNO3溶液和1×10-4 mol•L-1 K2Cr04溶液混合,不会有Ag2CrO4沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
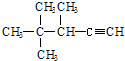 的系统名称为( )
的系统名称为( )| A. | 2,2,3-三甲基-1-戊炔 | B. | 3,4,4-三甲基-4-戊炔 | ||
| C. | 3,4,4-三甲基-1-戊炔 | D. | 2,2,3-三甲基-4-戊炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
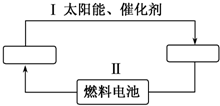 氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.请在如图中的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).
氢能源是21世纪极具发展前景的新能源之一,它既是绿色能源,又可循环使用.请在如图中的两个空格中填上循环过程中反应物和生成物的分子式,以完成理想的氢能源循环体系图(循环中接受太阳能的物质在自然界中广泛存在).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的氯化铵溶液,用蒸馏水稀释10倍后,溶液的pH=5 | |
| B. | pH=3的盐酸与pH=3的CH3COOH溶液相比,c(Cl-)>C(CH3COO-) | |
| C. | pH=2的一元酸HA溶液与pH=12的NaOH溶液以体积比1:1混合后,c(Na+)≤c(A-) | |
| D. | pH相同的NaOH、NaClO两种溶液中水的电离程度相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com