

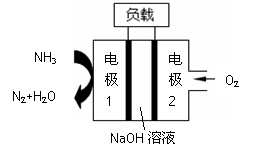
瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电
池示意图如右,有关说法正确的是
A.电池工作时,Na+ 向负极移动
B.电子由电极2经外电路流向电极1
C.电池总反应为:4NH3+3O2=2N2+6H2O
D.电极2发生的电极反应为:O2+ 4H + + 4e-=2H2O
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
某含氧有机化合物,它的相对分子质量为88.0,含C的质量分数为68.2%,含H的质量分数为13.6%,经红外光谱测定含有一个羟基,核磁共振氢谱显示该分子中有3个甲基,且有三种不同环境的氢原子,请通过计算写出其结构简式。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。
(1)X元素是 (填名称) ,W在周期表中的位置 。
(2)X与Y 形成化合物的电子式为 ,X与W组成的化合物中存在 键(填“离子”“共价”)。
(3)①写出实验室制备YX3的化学方程式:
②工业上也可以选择合适的条件进行YX3的合成,若已知在该条件下每生成2 mol YX3气体时放出
92.4kJ的热量,写出该反应的热化学方程式
(4)由X、Y、Z、W四种元素组成的一种离子化合物A。已知1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。则A的名称是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
以粗氧化锌粉(含FeO、Fe2O3、ZnS等)制取活性ZnO的工艺如下:
步骤1:以H2SO4浸出粗氧化锌,同时加入H2O2;
步骤2:过滤,调节滤液的pH;
步骤3:过滤,向滤液中加NH4HCO3,得碱式碳酸锌沉淀;
步骤4:过滤、洗涤、煅烧,得产品。
已知:离子沉淀的pH见下表。
| 离子 | 开始沉淀pH | 沉淀完全pH |
| Fe2+ | 7.6 | 9.6 |
| Fe3+ | 2.7 | 3.7 |
| Zn2+ | 5.4 | 8.0 |
(1)加入H2O2时能浸出硫化锌,同时生成淡黄色固体,写出其化学方程式 ▲ 。
(2)步骤2中调节溶液pH的范围是 ▲ 。
(3)取洗涤、干燥后的碱式碳酸锌68.2 g,充分灼烧后测得残留物质的质量为48.6 g,将所得气体通入足量澄清石灰水中,得沉淀20 g。计算碱式碳酸锌的组成(用化学式表示,写出计算过程)。 ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质与应用不对应的是
A.氨气具有还原性,可用作制冷剂
B.MgO、Al2O3熔点高,可用于制作耐火材料
C.Na2CO3溶液显碱性,可用其热溶液除去金属餐具表面油污
D.常温下浓硫酸能使铝发生钝化,可在常温下用铝制容器贮运浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,有①氨水、②NH4Cl溶液、③Na2CO3溶液、④NaHCO3溶液各25mL,物质的
量浓度均为0.1mol·L−1,下列说法正确的是
A.四种溶液的pH的大小顺序:①>④>③>②
B.将溶液①、②等体积混合所得碱性溶液中:c(NH4+)<c(NH3·H2O)
C.向溶液①、②中分别滴加25mL 0.1mol·L−1盐酸后,溶液中c(NH4+):①<②
D.将溶液③、④等体积混合所得溶液中:
2c(OH−)-2c(H+)=3c(H2CO3)+c(HCO3-)-c(CO32−)
查看答案和解析>>
科目:高中化学 来源: 题型:
无水AlCl3可用作有机合成的催化剂、食品膨松剂等。
工业上由铝土矿(主要成分是A12O3和Fe2O3)和石油焦(主要成分是C)按下图所示流
|
|
|
| |||||||||||
 | |||||||||||
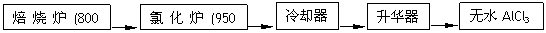 | |||||||||||
|
|
|
(1)氯化铝在加热条件下易升华,气态氯化铝的化学式为Al2Cl6,每种元素的原子最外层均达到8电子稳定结构,则AlCl3是: ▲ 晶体,其结构式为: ▲ 。
(2)氯化炉中Al2O3、Cl2和C反应的化学方程式是 ▲ 。
(3)冷却器排出的尾气中含有大量CO和少量Cl2,需用Na2SO3溶液除去Cl2,此反应的离子方程式为: ▲ 。
(4)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是: ▲ 。
(5)AlCl3产品中Fe元素含量直接影响其品质,为测定产品中Fe元素的含量,现称取16.25g无水AlCl3产品,溶于过量的NaOH溶液,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重残留固体质量为0.32g。则产品中Fe元素的含量为: ▲ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某原电池的总反应的离子方程式是Zn + Cu2+ = Zn2+ + Cu,该原电池的组成正确的是:
| A | B | C | D | |
| 正极 | Zn | Ag | Cu | Cu |
| 负极 | Cu | Cu | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
将等物质的量浓度的CuSO4溶液和NaCl溶液等体积混合后,用石墨电极
进行电解,电解中溶液pH随时间t变化的曲线如图,则下列说法正确的是
A.阳极产物一定是Cl2,阴极产物一定是Cu
B.BC段表示在阴极上是H+放电产生了H2
C.整个过程中阳极先产生Cl2,后产生O2
D.CD段表示阳极上OH一放电破坏了水的电离平衡,产生了H+

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com