
| △ |
| △ |
| m |
| M |
| n |
| V |
| 1 |
| 2 |
| m |
| M |
| △ |
| 50.4g |
| 56g/mol |
| 96g |
| 32g/mol |
| △ |
| ||
|
| 1 |
| 2 |
| 11.2L |
| 22.4L/mol |
| △ |
| △ |
| 0.025mol×152g/mol |
| 250mL×1.12g/mL |
| 7 |
| 56 |
| 16 |
| 32 |
| △ |
| 50.4g |
| 56g/mol |
| 96g |
| 32g/mol |
| △ |
 可知,n(CaS2):n(CaS5)=1:2;
可知,n(CaS2):n(CaS5)=1:2;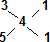 可知,n(CaS3):n(CaS5)=1:1,
可知,n(CaS3):n(CaS5)=1:1,

 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案科目:高中化学 来源: 题型:
| A、c(NH4+):③>② |
| B、pH:①>②>③ |
| C、Mg(OH)2溶于②的主要原因是由于NH4+水解使溶液显酸性,导致平衡Mg(OH)2(s)═Mg2+(aq)+2OH-(aq)向溶解方向移动 |
| D、等体积 ①和 ③混合溶液中 c(Cl-)>c(NH4+)>c(H+)>c(CH3COO-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、磁性氧化铁溶于稀硝酸:Fe3O4+8H+=Fe2++2Fe3++4H2O |
| B、Na2S溶液呈碱性:S2-+2H2O?H2S+2OH- |
| C、向硝酸银溶液中逐滴滴入稀氨水至过量:Ag++2NH3?H2O=[Ag(NH3)2]++2H2O |
| D、Ca(HCO3)2与过量Ca(OH)2溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、当酸碱恰好完全中和时,溶液呈中性 |
| B、若溶液中c(H+)与c(OH-)相等,溶液肯定呈中性 |
| C、0.005 mol?L-1 Ba(OH)2溶液中,水电离出的c(OH-)为10-12 mol?L-1 |
| D、NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将pH试纸放入溶液中,观察其颜色变化并与标准比色卡对照 |
| B、将溶液倒在pH试纸上,观察其颜色变化并与标准比色卡对照 |
| C、用干燥、洁净玻璃棒蘸取溶液,滴在pH试纸上,观察其颜色变化并与标准比色卡对照 |
| D、在试管内放入少量溶液并煮沸,把pH试纸放在管口观察其颜色并与标准比色卡对照 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
某化学兴趣小组对碳的氧化物做了深入的研究并取得了一些成果.
| ||
| 实验组序 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | |
| H2O | CO | CO2 | |||
| 1 | 500 | 4 | 8 | 3.2 | 4 |
| 2 | 750 | 2 | 4 | 0.8 | 3 |
| 3 | 750 | 2 | 4 | 0.8 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com