
| A、Fe2(SO4)3 |
| B、Na2CO3 |
| C、KNO3 |
| D、FeSO4 |


科目:高中化学 来源: 题型:
| A、若a=b=3,8>m>n>b,则元素非金属性:X>Y |
| B、若a<b<m=n=4,则晶体类型相同时,其单质熔点:Y<X |
| C、若Y的气态氢化物化学式为YHn,且b<4,则该氢化物易溶于水 |
| D、若a<b=3,m=n=7,已知原子半径大小:Y>N(氮原子)>X,则NX3、NY3与水反应生成不同的含氮化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
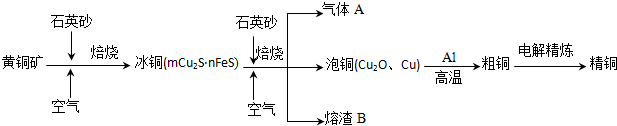
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1molCl2常温下与过量NaOH溶液反应转移电子总数为0.1NA |
| B、25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA |
| C、0.25molNa2O2中含有的阴离子数为0.5NA |
| D、18gD2O(重水)完全电解,转移的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
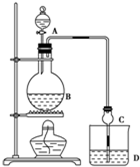 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点/℃ | 34.7 | 78.5 | 118 | 77.1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com