
化学与社会、科学、技术、环境等有密切联系。下列有关说法正确的是
A.用浸泡过酸性高锰酸钾溶液的硅藻土吸收水果产生的乙烯以达到保鲜目的
B.PM 2.5是指氮、硫的氧化物溶于水形成的酸性液体造成的空气污染
C.新型材料聚酯纤维、光导纤维都属于有机高分子
D.在食品袋中放入盛有硅胶的透气袋,可防止食物氧化变质
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2017届福建省高三上联考二化学卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W的原子序数依次增大。X是地壳中含量最高的元素,Y+与X2-具有相同的电子层结构,Y与Z位于相邻主族,W与X同主族。下列说法正确的是
A. W的氢化物比X的氢化物稳定
B. Y在周期表中的位置为第3周期、IB族
C. Z的最高价氧化物对应的水化物的碱性比Y的弱
D. X的单质与含W化合物不可能发生置换反应
查看答案和解析>>
科目:高中化学 来源:2017届广东省深圳市三校高三上学期第一次联考化学卷(解析版) 题型:实验题
甲同学将Na2O2分别与H2O和浓盐酸反应,有如下现象:
实验序号 | 使用药品 | 现象 |
Ⅰ | Na2O2、H2O | ① |
Ⅱ | Na2O2、浓盐酸 | ①试管壁发热;②刺激性气味的气体产生;③反应后所得溶液呈浅黄绿色 |
请完成下 列问题:
列问题:
实验I中:
⑴该反应是 反应(填“放热”或“吸热”)。
⑵反应的化学方程式是: 。
⑶证明无色无味气体是氧气的方法是:  。
。
实验Ⅱ中:
⑷根据现象②、③,推测生成的气体中可能含有Cl2,产生Cl2的化学方程式是: 。
⑸若往“浅黄绿色溶液”中加入FeCl3溶液,立即产生与实验I相同的气体 ,原因是:
,原因是:  。
。
查看答案和解析>>
科目:高中化学 来源:2017届广东省深圳市三校高三上学期第一次联考化学卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是( )(可能用到的相对原子质量:O—16 Na—23)
A.含1 mol FeCl3的饱和溶液最多可形成胶体粒子数为NA
B.1 mol Fe溶于过量硝酸,电子转移数为2 NA
C.100 mL 2 mol·L-1碳酸钠溶液中,CO 离子数为0.2 NA
离子数为0.2 NA
D.7.8 g过氧化钠与水反应时转移的电子数为0.1 NA
查看答案和解析>>
科目:高中化学 来源:2017届广东省韶关市高三上高考调研理综化学试卷(解析版) 题型:选择题
2015年斯坦福大学研究人员研制出一种可在一分钟内完成充放电的超常性能铝离子电池,内部用AlCl4-和有机阳离子构成电解质溶液,其放电工作原理如图所示。下列说法不正确的是
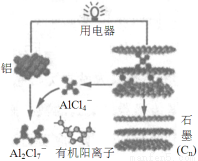
A.放电时,铝为负极、石墨为正极
B.放电时,有机阳离子向铝电极方向移动
C.放电时的负极反应为:Al –3e-+ 7AlCl4-= 4Al2Cl7-
D.充电时,AlCl4-向石墨电极方向移动
查看答案和解析>>
科目:高中化学 来源:2017届广东省汕头市高三上学期期末化学试卷(解析版) 题型:实验题
化学兴趣小组的同学利用下图所示装置进行某些气体的制备、性质等实验(图中夹持装置有省略)
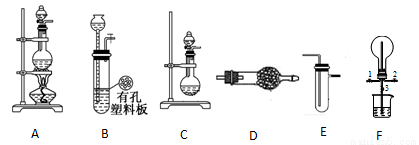
请回答下列问题:
(1)根据上述实验装置,用MnO2和浓盐酸制备纯净、干燥的Cl2,可选用的发生、净化装置连接顺序为 →E→接E,第一个E装置的药品是 。
(2)根据上述实验装置,为制备干燥NH3,可选用的发生、净化装置为 接 。其中发生装置中可以选用的药品为 (填选项字母)
a.碱石灰和浓氨水 b.浓H2SO4和浓氨水 c.碱石灰和氯化铵 d.生石灰和氯化铵
(3)一定条件下,Cl2 与CH4在装置F中发生反应,其有机物有 。(填化学式)
(4)利用装置F可探究Cl2和NH3的反应。
已知Cl2与NH3可发生反应:3Cl+2NH3=N2+6HCl,实验时打开开关1、3,关闭2,先向烧瓶中通入Cl2,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的NH3。
①不能先通入NH3的原因: 。
②试验一段时间后烧瓶内出现的现象为: 。
③装置F中烧杯内发生反应的离子方程式为: 。
④请设计一个实验方案(操作过程、实验现象)鉴定烧瓶内最终固体产物的阳离子,其方案为: 。
查看答案和解析>>
科目:高中化学 来源:2017届广东省汕头市高三上学期期末化学试卷(解析版) 题型:选择题
化学与社会、生活、技术和环境密切相关。下列有关说法中不正确的是
A.有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低,极易被引燃,加热时最好用水浴加热
B.石油裂解、海水制镁、纤维素制火棉都包含化学变化
C.大分子化合物油脂在人体内水解为氨基酸和甘油等小分子才能被吸收
D.苹果放在空气中久置变黄和纸张久置变黄原理相似
查看答案和解析>>
科目:高中化学 来源:2017届广东省清远市清城区高三上期末B卷化学试卷(解析版) 题型:选择题
对于在一定条件下进行的化学反应:2SO2+O2?2SO3,改变下列条件,可以提高反应物中的活化分子百分数的是( )
A.升高温度 B.增大压强 C.减小反应物浓度 D.增大反应物浓度
查看答案和解析>>
科目:高中化学 来源:2017届湖南省株洲市高三上教学质检一化学试卷(解析版) 题型:选择题
常温下,CaSO4[Ksp(CaSO4)=9×10-6] 在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

A.在任何溶液中,c(Ca2+)·c(SO42-)均相等
B.d点溶液通过蒸发可以变到c点
C.b点对应的Ksp大于a点对应的Ksp
D.b点将有沉淀生成,平衡后溶液中c(SO42-)一定小于3×10-3 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com