
| A. | 0.1NA的NO在一密闭容器中与足量氧气完全反应,得到0.1molNO2 | |
| B. | 一定条件下的密闭容器中,6.4gSO2可被氧气氧化得到SO3的分子数为0.1NA | |
| C. | 常温下18g铝放入足量浓硫酸中转移电子数2NA | |
| D. | 1L0.1mol/L FeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1NA |
分析 A、NO2气体中存在平衡:2NO2?N2O4;
B、二氧化硫和氧气的反应为可逆反应;
C、常温下,铝在浓硫酸中钝化;
D、一个氢氧化铁胶粒是多个氢氧化铁的聚集体.
解答 解:A.NO2气体中存在平衡:2NO2?N2O4,故0.1NA的NO与氧气反应后生成的NO2会自动化合成N2O4,导致得到的NO2小于0.1mol,A错误;
B.SO2和氧气的反应是可逆反应,SO2不能完全转化成SO3,故SO3的分子数小于0.1NA,故B错误;
C.铝在浓硫酸中发生钝化,因生成氧化膜阻止反应的继续进行,故铝不能反应完全,则转移的电子数小于2NA个,故C错误;
D.一个氢氧化铁胶粒是多个氢氧化铁的聚集体,所以1L0.1mol/LFeCl3溶液完全水解得到的Fe(OH)3胶体微粒数小于0.1NA,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 氨水使酚酞溶液变红的原因:NH3•H2O═NH4++OH- | |
| B. | 硫酸氢钠溶液显酸性:NaHSO4?Na++H++SO42- | |
| C. | 明矾净水原理:Al 3++3 H2O?Al(OH)3↓+3 H+ | |
| D. | 制备TiO2纳米粉:TiCl4+(x+2)H2O(过量)?TiO2•xH2O↓+4 HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
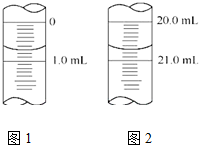 维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6.人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸.维生素C易被空气中的氧气氧化.在新鲜水果、蔬菜、乳制品中都含维生素C,如新鲜橙汁中维生素C的含量在500mg•L-1左右.某校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量.下面是测定实验分析报告,请填写有关空白.
维生素C是一种水溶性维生素(其水溶液呈酸性),它的分子式是C6H8O6.人体缺乏这种维生素易得坏血症,所以维生素C又称抗坏血酸.维生素C易被空气中的氧气氧化.在新鲜水果、蔬菜、乳制品中都含维生素C,如新鲜橙汁中维生素C的含量在500mg•L-1左右.某校课外活动小组测定了某品牌的软包装橙汁中维生素C的含量.下面是测定实验分析报告,请填写有关空白.| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R的氢化物比Y的氢化物的沸点更高 | |
| B. | X与Z组成的化合物溶于水呈碱性 | |
| C. | 只有Y元素存在同素异形体 | |
| D. | X、Y、Z、R形成简单离子的半径依次增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
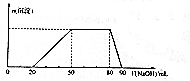 某50 mL溶液中可能含有H+、Na+、NH4+、Mg2+、Al3+、SO42-等离子,当向该溶液中加入5 mol•L-1NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积V(NaOH)变化关系如图所示.下列说法正确的是( )
某50 mL溶液中可能含有H+、Na+、NH4+、Mg2+、Al3+、SO42-等离子,当向该溶液中加入5 mol•L-1NaOH溶液时,发现生成沉淀的物质的量n(沉淀)随NaOH溶液的体积V(NaOH)变化关系如图所示.下列说法正确的是( )| A. | 原溶液中一定存在Mg2+、Al3+、H+、SO42- | |
| B. | 原溶液中Al3+的浓度为1mol•L-1 | |
| C. | 原溶液中NH4+的物质的量为0.4mol | |
| D. | 当加入的NaOH的溶液的体积为90mL时,反应后溶液中的离子只有Na+和SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Ba2+、Br-、CO32- | B. | K+、Na+、SO42-、MnO4- | ||
| C. | Cl-、SCN-、Fe3+、H+ | D. | Na+、H+、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HNO3>H2CO3>H2SiO3 | B. | 稳定性;H2S>H2O>HF | ||
| C. | 还原性:Cl->Br->I- | D. | 碱性:NaOH>Mg(OH)2>Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
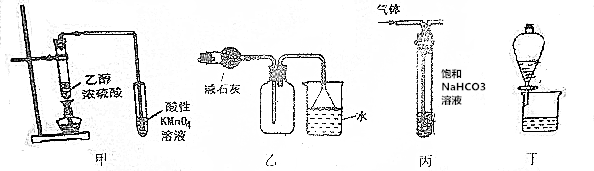
| A. | 装置甲可用于检验乙烯生成 | |
| B. | 装置乙可用于收集和吸收氨气 | |
| C. | 装置丙可用于出去CO2中混有的SO2气体 | |
| D. | 装置丁可分离碘的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com