
| A. | PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 | |
| B. | 为增强氯水的漂白性,可以向其中加入碳酸钙 | |
| C. | NaH与重水反应的方程式:NaH+D2O═NaOH+D2↑ | |
| D. | 均含有NA个电子的H2O和CH4具有相同的体积 |
分析 A.如果中心原子价电子数+其化合价的绝对值=8,则该分子中所有原子都达到8电子稳定结构,但氢化物除外;
B.氯水中含有HCl、HClO,起漂白作用的是HClO,氯水中HCl能和碳酸钙反应,但HClO不和碳酸钙反应;
C.NaH和重水反应生成HD;
D.水和甲烷分子中电子数都是10,均含有NA个电子的H2O和CH4物质的量相等,如果是常温常压下,水是液体,气体摩尔体积对其不适用.
解答 解:A.如果中心原子价电子数+其化合价的绝对值=8,则该分子中所有原子都达到8电子稳定结构,但氢化物除外,PCl3分子中P原子价电子数是5,其化合价为+3,所以为8,则该分子中所有原子都具有8电子结构;而BCl3分子中B原子最外层电子数是3、其化合价为+3,所以该分子中并不是所有原子都达到8电子结构,故A错误;
B.氯水中含有HCl、HClO,起漂白作用的是HClO,氯水中HCl能和碳酸钙反应,但HClO不和碳酸钙反应,碳酸钙和盐酸反应促进氯气和水的反应,所以次氯酸浓度增大,则溶液的漂白性增强,故B正确;
C.NaH和重水反应生成HD,所以反应方程式为NaH+D2O═NaOD+HD↑,故C错误;
D.水和甲烷分子中电子数都是10,均含有NA个电子的H2O和CH4物质的量相等,如果是常温常压下,水是液体,气体摩尔体积对其不适用,所以无法判断二者体积是否相等,故D错误;
故选B.
点评 本题考查较综合,涉及8电子稳定结构判断、化学平衡影响因素、氧化还原反应、物质的量的有关计算等知识点,为高频考点,侧重考查学生分析计算能力,注意气体摩尔体积适用范围和适用条件、注意C中反应实质,为易错点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题

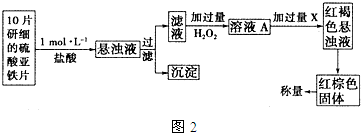
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molNa2O2与水反应转移电子数为0.1 NA | |
| B. | 标准状况下,11.2L HF含有的分子数为0.5 NA | |
| C. | 1mol S在足量O2中燃烧,转移的电子数为6 NA | |
| D. | 7.8g Na2O2固体中所含阴离子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢键是化学键 | |
| B. | 甲烷可与水形成氢键 | |
| C. | 乙醇分子跟水分子之间存在范德华力和氢键 | |
| D. | 碘化氢的沸点比氯化氢的沸点高是由于碘化氢分子之间存在氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
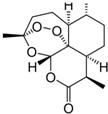 我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )
我国女药学家屠呦呦作为抗疟新药青蒿素的第一发明人荣获2015年诺贝尔生理学或医学奖.青蒿素的结构如图所示,下列关于青蒿素的说法错误的是( )| A. | 青蒿素的化学式为C15H22O5 | |
| B. | 青蒿素的同分异构体可能有芳香族化合物 | |
| C. | 青蒿素可与NaOH溶液发生水解反应 | |
| D. | 青蒿素可用蒸馏水从植物提取 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
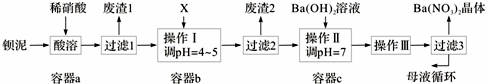
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
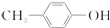 出发合成BHT的方法有如下两种.下列说法不正确的是( )
出发合成BHT的方法有如下两种.下列说法不正确的是( )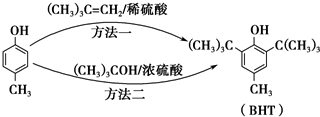
| A. | 推测BHT在水中的溶解度小于苯酚 | |
| B. | 方法一和方法二的反应类型都是加成反应 | |
| C. | BHT与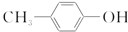 都能使酸性KMnO4褪色 都能使酸性KMnO4褪色 | |
| D. | BHT与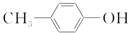 具有完全相同的官能团 具有完全相同的官能团 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75% | 11.44% | 13.56% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
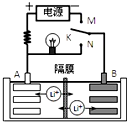 如图是一种可充电的锂离子电池充、放电的工作示意图.该电池的反应式为:
如图是一种可充电的锂离子电池充、放电的工作示意图.该电池的反应式为:| A. | K与N相接时,A极为负极,该电极反应式为:LixC6-xeˉ=C6+xLi+ | |
| B. | 该电池的比能量与用单质锂作电极的锂电池的比能量相同 | |
| C. | K与M相接时,A极发生氧化反应,LiMnO2-xeˉ=Li1-xMnO2+xLi+ | |
| D. | K与N相接时,Li+由A极区迁移到B极区 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com