
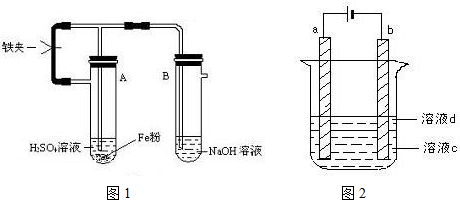
分析 方法一:隔绝空气的复分解反应法,实验时可将氢氧化钠溶液煮沸,以排出溶液中的氧气,配制硫酸亚铁溶液时,可取适量绿矾于小烧杯中,加入煮沸的H2O和少量稀H2SO4,并加入Fe粉,完全搅拌,过滤后将滤液移入细口试剂瓶,氢氧化钠溶液与硫酸亚铁反应时,应注意隔绝空气;
方法二:装入药品后,先打开铁夹,H2经导管入B管,将B中的空气从侧管导出,然后在反应较缓时,夹住铁夹,产生的H2的压强将含Fe2+的溶液由A压入B的NaOH溶液中,产生白色的Fe(OH)2沉淀;
方法三:用石墨和Fe作电极制取白色纯净Fe(OH)2沉淀,应该用Fe作阳极、石墨作阴极,电解质为活泼金属的盐,为防止生成的氢氧化亚铁被氧化,需要加入和水不互溶的有机物且密度小于水.
解答 解:方法一:
(2)配置纯FeSO4溶液时,可取适量绿矾于小烧杯中,加入煮沸的H2O和少量稀H2SO4,并加入Fe粉,完全搅拌,过滤后将滤液移入细口试剂瓶,
故答案为:取适量绿矾于小烧杯中,加入煮沸的H2O和少量稀H2SO4,并加入Fe粉,完全搅拌,过滤后将滤液移入细口试剂瓶;
(3)制备氢氧化亚铁时,应防止生成的氢氧化亚铁被氧化,可取适量FeSO4溶液,加入少量苯,保证起油膜作用.再将吸有NaOH的胶头滴管悬垂于试管上方,逐滴加入NaOH溶液,苯层下有白色的Fe(OH)2沉沉生成,
故答案为:取适量FeSO4溶液,加入少量苯,保证起油膜作用.再将吸有NaOH的胶头滴管悬垂于试管上方,逐滴加入NaOH溶液,苯层下有白色的Fe(OH)2沉沉生成;
方法二:
(1)A装置内铁与硫酸反应生成硫酸亚铁和氢气,A内压强增大,将生成的硫酸亚铁压入B内与氢氧化钠反应生成白色的氢氧化亚铁沉淀,此时打开止水夹,氢气进入B装置,排除装置内的空气,
故答案为:装入药品后,先打开铁夹,H2经导管入B管,将B中的空气从侧管导出,在反应较缓时,夹住铁夹,产生的H2的压强将含Fe2+的溶液由A压入B的NaOH溶液中,产生白色的Fe(OH)2沉淀;
(2)Fe(OH)2是在H2的还原气氛中产生的,隔绝空气,可防止被氧化,
故答案为:因为Fe(OH)2是在H2的还原气氛中产生的;
方法三:
(1)制纯净的Fe(OH)2沉淀,则Fe为阳极,失去电子,b与电源正极相连,则b为阳极,发生的电极反应为Fe-2e-=Fe2+,故答案为:铁棒;Fe-2e-=Fe2+;
(2)纯水导电性太差,影响物质的制备,而NaOH溶液中氢离子放电,可生成Fe(OH)2沉淀,无水乙醇不导电,在硫酸溶液中不能得到氢氧化亚铁,
故答案为:B;
(3)铁做阳极,被氧化生成氢氧化铁,阴极上生成氢气,总方程式为Fe+2H2O$\frac{\underline{\;电解\;}}{\;}$Fe(OH)2↓+H2↑,
故答案为:Fe+2H2O$\frac{\underline{\;电解\;}}{\;}$Fe(OH)2↓+H2↑;
(4)苯的密度水的小,不溶于水,可隔绝空气,防止氢氧化亚铁被氧化,故答案为:苯;隔绝空气,防止Fe(OH)2被氧化;
(5)反接电源时,电解方程式是2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑,生成的O2会将Fe(OH)2氧化,其现象是白色沉淀迅速变为灰绿色,最终变为红褐色,
故答案为:白色沉淀变为灰绿色,最终变为红褐色沉淀.
点评 本题考查物质的制备,为高频考点,侧重于学生的分析能力和实验能力的考查,透彻理解实验原理,掌握方案设计的基本思路和方法是解答的关键,注意Fe(OH)2很容易被空气中的氧气氧化,这是Fe(OH)2的重要性质,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②③ | C. | ②④ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于C2H4(g)+H2O(g)?C2H5OH(g),在一定条件下达到平衡状态时,体系的总压强为P,其中C2H4(g)、H2O(g)、C2H5OH(g)均为1mol,则用分压表示的平衡常数Kp=$\frac{3}{P}$ | |
| B. | 恒温恒压下,在一容积可变的容器中,反应2A(g)+B(g)?2C(g)达到平衡时,A、B和C的位置的量分别为4mol、2mol和4mol,若此时A、B和C均增加1mol,平衡正向移动 | |
| C. | 恒温恒压下,在一容积可变的容器中,N2(g)+3H2(g)?2NH3(g)达到平衡状态时,N2、H2、NH3各1mol,若此时再充入3molN2,则平衡正向移动 | |
| D. | 对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和平衡分压表示的平衡常数,其数值不同,但意义相同,都只与温度有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
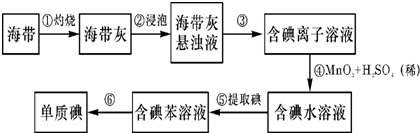
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
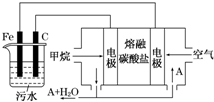 电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀.Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用电浮选凝聚法处理污水,设计装置示意图,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| B. | 标准状况下,11.2 LSO3含有的分子数目为0.5 NA | |
| C. | 7.8gNa2O2所含的离子数为0.4NA | |
| D. | 11.2LCl2完全溶于NaOH溶液,电子转移数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应Cl2被氧化 | ||
| C. | 该反应不属于复分解反应 | D. | 生成1mol N2有6mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=+242 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(l)△H=-484 kJ/mol | ||
| C. | H2O(g)═H2(g)+$\frac{1}{2}$O2(g)△H=+242 kJ/mol | D. | 2H2(g)+O2(g)═2H2O(g)△H=+484 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
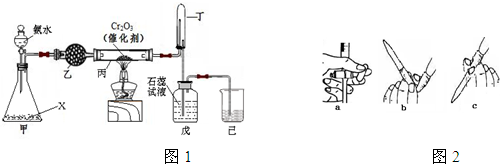
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com