
【题目】氢氧化镍在乙醇的悬浊液中可发生反应生成单质镍的配合物:Ni(OH)2+5CH3NC=(CH3NC)4Ni+CH3NCO+H2O。
(1)基态镍原子的未成对电子数为__,钯(Pd)与镍位于同一族,且Pd是Ni的下一周期元素,基态钯原子的未成对电子数为0,基态钯原子的外围电子排布式为___。
(2)CH3NCO中四种元素的第一电离能由大到小的顺序为___。CH3NC(结构简式为CH3—N≡C)分子中甲基碳原子的杂化轨道类型是___。
(3)用光气(COCl2)与甲胺(CH3NH2)可以制取CH3NCO。与COCl2互为等电子体的一种阴离子为___。
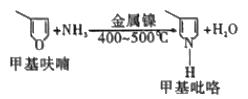
(4)如图,在镍的催化作用下,甲基呋哺与氨在高温下反应得到甲基吡咯。甲基吡咯的熔、沸点高于甲基呋喃的原因是_____________。
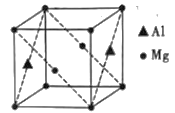
(5)(CH3NC)4Ni可作为储氢材料,某种镁铝合金也可作为储氢材料,该合金晶胞结构如图所示,晶胞棱长为anm,该合金的化学式为___,该晶体的密度为__g·cm-3(阿伏加德罗常数的数值用NA表示)。
【答案】2 4d10 N>O>H>C sp3 CO32-或NO3- 甲基吡咯分子间存在氢键 Mg2Al ![]()
【解析】
(1)Ni是28号元素,原子核外电子排布式为1s22s22p63s23p63d84s2,3d能级有2个未成对电子,基态镍原子的未成对电子数为2;钯(Pd)与镍位于同一族,且Pd是Ni的下一周期元素,基态钯原子的未成对电子数为0,5s上电子数为0,基态钯原子的外围电子排布式为4d10。故答案为:2;4d10;
(2)周期主族元素随着原子序数增大,第一电离能呈增大的趋势,但第ⅡA族和第ⅤA元素反常,所以C、N和O的第一电离能由大到小的顺序为:N>O>C,又 H原子比碳原子的核外电子距离原子核近,受到原子核的引力大,电离需要消耗更多的能量,所以H第一电离能比C的大,故CH3NCO中四种元素的第一电离能由大到小的顺序为N>O>H>C。甲基中C原子VP=BP+LP=4+![]() =4,CH3NC(结构简式为CH3—N≡C)分子中甲基碳原子的杂化轨道类型是sp3。故答案为:N>O>H>C;sp3;
=4,CH3NC(结构简式为CH3—N≡C)分子中甲基碳原子的杂化轨道类型是sp3。故答案为:N>O>H>C;sp3;
(3)将两个Cl换成O可得与COCl2互为等电子体的一种阴离子为CO32-,再将CO32-中C换成N,又可得到NO3-。故答案为:CO32-或NO3-;
(4)甲基呋哺分子中O上无H,分子间不能形成氢键,甲基吡咯的熔、沸点高于甲基呋喃的原因是甲基吡咯分子间存在氢键。故答案为:甲基吡咯分子间存在氢键;
(5)该晶胞中Al原子个数为2×![]() =1、Mg原子个数=8×
=1、Mg原子个数=8×![]() +2×
+2×![]() =2,所以其化学式为Mg2Al;晶胞体积=(a×10-7 cm)3,该晶体的密度=
=2,所以其化学式为Mg2Al;晶胞体积=(a×10-7 cm)3,该晶体的密度= g·cm-3=
g·cm-3=![]() g·cm-3,故答案为:Mg2Al;
g·cm-3,故答案为:Mg2Al;![]() 。
。


科目:高中化学 来源: 题型:
【题目】若4.6 g Na在足量氧气中一段时间后,生成固体的质量为7.1 g,则生成的固体可能为( )
A.Na 和Na2OB.Na 和Na2O2C.Na 和Na2O2D.Na2O 和Na2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向物质Y中逐渐加入(或通入)X溶液,生成沉淀的量与加入X的物质的量关系如图所示,下表中符合图示情况的是
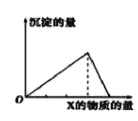
A | B | C | D | |
X | CO2 | HCl | NaOH | AlCl3 |
Y | Ca(OH)2 | NaAlO2 | AlCl3 | NaOH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生课外活动小组,模拟呼吸面具中的反应原理,设计用如图所示的仪器来制取氧气并测量氧气的体积。图中量气装置E由甲、乙两根玻璃管组成,它们由橡皮管连通,并装入适量水。甲管有刻度(0—50mL),供量气用;乙管可上下移动调节液面高低。
实验可供选用的药品还有:稀硫酸、盐酸、过氧化钠、碳酸钠、大理石、水。

试完成下列问题:
(1)图中各装置接口连接顺序是___(填各接口的编号,其中连接胶管及夹持装置均省略)。
(2)装置C中放入的两种反应物是____。
(3)装置A的作用是___,装置B的作用是___。
(4)为了较准确测量氧气的体积,除了必须检查整个装置的气密性之外,在读反应前后甲管中液面的读数及求其差值的过程中,应注意___(填字母编号,2项)。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平
d.读数时不一定使甲、乙两管液面相平
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种水系锌离子电池总反应式为xZn+Zn1-xMn2O4![]() ZnMn2O4.(0<x<1)。下列说法错误的是( )
ZnMn2O4.(0<x<1)。下列说法错误的是( )
A.充电时,阳极的电极反应式为Zn1-xMn2O4+xZn2++2xe-=ZnMn2O4
B.放电时,Zn2+向正极迁移
C.充放电过程中锌与锰的化合价都发生变化
D.放电时,每转移1mole-正极质量增加32.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究硫酸亚铁的分解产物,将硫酸亚铁样品装入下图的硬质玻璃管中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红棕色粉末。
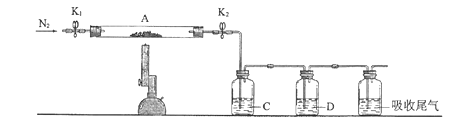
(1)C中的溶液为_______(填标号)。D中观察到的现象为___________。
a .品红 b .NaOH c. BaCl2 d. Ba(NO3)2 e. 浓H2SO4
(2)写出硫酸亚铁高温分解反应的化学方程式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铋(Bi)的化合物在电子、医药等领域应用广泛。由辉铋矿(主要成分为Bi2S3, 含杂质SiO2等,Bi2S3不溶于水和硫酸)制备Bi2O3的工艺如下。
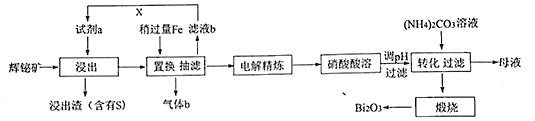
回答下列问题:
(1)试剂a最好选用的试剂是______________(填选项字母);
A. HCl溶液 B.浓H2SO4 C. H2O2溶液 D. FeCl3和HCl混合液
(2)辉铋矿的浸出液中铋元素主要以Bi3+形式存在,写出浸出过程生成S渣的离子方程式_______,“滤液b”中通入气体X后可循环利用,气体X是_______________ (写化学式);
(3)“抽滤”用如下装置完成,请选择字母代号补全正确的操作顺序(洗涤操作只做一次):

开抽气泵→a→b→d→ ____→c→ 关抽气泵;
a.转移固液混合物 b.关活塞A c.开活塞A d.确认抽干 e.加洗涤剂洗涤
(4)写出“煅烧”碱式碳酸铋[(BiO)2CO3]制备Bi2O3 的化学方程式____________________________;
(5)硝酸酸溶后调pH可得到碱式硝酸铋,碱式硝酸铋直接灼烧也能得到Bi2O3,上述工艺中却转化为碱式碳酸铋再灼烧,除了能改良产品性状,另一优点是__________________________________________;
(6)从“母液”中回收可用做炸药的物质是_________ ( 写物质名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在汽车上安装高效催化转化器,可发生反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) △H,减少汽车尾气污染。某研究性学习小组在两个初始条件完全相同的恒温恒容密闭容器中充入一定量的NO和CO气体,甲组不加催化剂,乙组加入催化剂,分别用气体传感器测得不同时间的NO和CO浓度如表:
N2(g)+2CO2(g) △H,减少汽车尾气污染。某研究性学习小组在两个初始条件完全相同的恒温恒容密闭容器中充入一定量的NO和CO气体,甲组不加催化剂,乙组加入催化剂,分别用气体传感器测得不同时间的NO和CO浓度如表:
时间(s) | 甲 | 乙 | |||||||||||
0 | 1 | 2 | 3 | 4 | 5 | 0 | 1 | 2 | 3 | 4 | 5 | ||
c(NO)(×10-4mol/L) | 10.0 | 10.0 | 10.0 | 10.0 | 10.0 | 10.0 | 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 | |
c(CO)(×10-3mol/L) | 3.60 | 3.60 | 3.60 | 3.60 | 3.60 | 3.60 | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 | |
下列说法正确的是:
A.通过甲乙组数据对比可知,催化剂可以让原来不能自发进行的反应体系自发进行
B.根据化学反应原理综合分析可知:反应2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) 的△H<0
N2(g)+2CO2(g) 的△H<0
C.乙容器中,0~
D.达到平衡后,将容器乙中各物质的浓度均加倍,则体系K值增加,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com