

分析 (1)根据溶液的配制过程,结合各仪器的作用选取仪器,配制一定物质的量浓度的溶液需要容量瓶、胶头滴管、量筒,不需要烧瓶、分液漏斗,定容方法是向容量瓶中加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切;
(2)已知亚硝酸钠(NaNO2)的水溶液呈弱碱性,说明是强碱弱酸盐,溶液中亚硝酸根离子水解,亚硝酸为弱酸;
(3)依据氧化还原反应电子守恒,结合元素化合价变化升降守恒配平书写离子方程式;
(4)利用高锰酸钾氧化亚硝酸根离子为硝酸根离子,过量的高锰酸钾被硫酸亚铁铵还原恰好反应,结合离子方程式的定量关系计算得到.
解答 解:(1)用容量瓶配制溶液,用胶头滴管定容;还需要用到的仪器有:溶解或稀释药品的烧杯、搅拌或引流用的玻璃棒,配制溶液时,定容的操作方法是,向容量瓶中加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切,
故答案为:AC;烧杯和玻璃棒;向容量瓶中加水至离刻度线1~2cm时,改用胶头滴管滴加水至液面与刻度线相切;
(2)已知亚硝酸钠(NaNO2)的水溶液呈弱碱性,说明是强碱弱酸盐,溶液中亚硝酸根离子水解,亚硝酸为弱酸,亚硝酸的电离方程式为:HNO2?H++NO2-,
故答案为:HNO2?H++NO2-;
(3)高锰酸根离子与亚硝酸根离子发生氧化还原反应,其中Mn元素的化合价从+7价降低到+2价,作氧化剂,而N元素的化合价从+3价升高到+5价,根据得失电子守恒,则高锰酸根离子、锰离子的系数是2,硝酸根、亚硝酸根离子的系数是5,根据电荷守恒,则反应物中有氢离子参加,;根据元素守恒,则产物中有水生成,氢离子的系数是6,水的系数是3,依据化合价变化升降相同和原子守恒配平写出离子方程式为:2MnO4-+5NO2-+6H+=2 Mn2++5NO3-+3H2O,单线桥表示电子的转移方向和数目,从还原剂指向氧化剂,方程式为: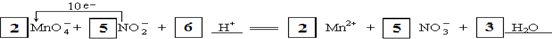
故答案为: ;
;
(4)依据反应过程和离子方程式可知
MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,
1 5
2×10-6mol 0.0010mol/L×0.01L
与亚硝酸根离子反应的高锰酸钾物质的量=0.012.00L×0.0005mol/L-2×10-6mol=4×10-6mol;
2MnO4-+5NO2-+6H+=2 Mn2++5NO3-+3H2O;
2 5
4×10-6mol 10-5mol
ag样品含 NaNO2的质量为69g/mol×10-5mol=6.9×10-4g;
1000g样品中含NaNO2的质量=$\frac{6.9×1{0}^{-4}mol×1000g}{ag}$=$\frac{0.69}{a}$g=$\frac{690}{a}$mg;
故答案为:$\frac{690}{a}$.
点评 本题考查了反应流程的分析判断,氧化还原反应的离子方程式书写和配平,物质性质的分析应用,滴定实验过程分析计算应用是解题关键,题目难度中等.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.15mol/L | B. | 0.20mol/L | C. | 0.225mol/L | D. | 0.30mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中KMnO4被氧化 | |
| B. | 反应中得到电子的物质是Cl2 | |
| C. | 每生成1 mol Cl2时,反应中转移的电子为2 mol | |
| D. | 被还原的HCl占参加反应HCl物质的量的3/8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 | |
| B. | 三者的单质放置在空气中均只生成氧化物 | |
| C. | 工业上,三者的单质目前都使用热还原法制得 | |
| D. | 电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
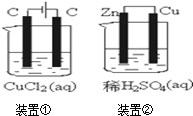
| A. | 两个装置中都发生了化学变化,都由化学能转变为电能 | |
| B. | 装置②中电流方向是从Zn经导线流入Cu | |
| C. | 反应开始阶段,两个装置中均有氢气产生 | |
| D. | 电极反应式:阳极2Cl--2e-→Cl2↑正极2H++2e-→H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+HCl$\stackrel{催化剂}{→}$CH3CH2Cl | ||
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | D. | 2C6H6+15O2$\stackrel{点燃}{→}$12CO2+6H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com