
(1)Y的元素符号是___________________。
(2)XW的电子式是________________。
(3)XW与YX3反应生成一种盐,该盐水溶液的pH_______________7(填“大于”“小于”或“等于”),其原因是(用离子方程式表示)___________________。
(4)Z元素氢化物的沸点比H2O_______________(填“低”或“高”)。Z元素的氢化物有毒,写出用CuSO4溶液吸收Z元素氢化物的离子方程式________________。
(5)已知X单质和Y单质反应生成YX3是可逆反应,ΔH<0。将X、Y的两种单质以等物质的量充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法正确的是_________________。
a.达到化学平衡时,任何一种物质的正反应速率与逆反应速率相等
b.反应过程中,Y单质的体积分数始终为50%
c.达到化学平衡时,X、Y两种单质在混合气体中的物质的量之比为1∶1
d.达到化学平衡的过程中气体平均相对分子质量减小
e.达到化学平衡后,升高温度,YX3的体积分数增大
解析:本题的突破口是“X元素原子的核外电子总数等于其电子层数”,可以判断为氢元素(H),“Z元素的气态氢化物和它的氧化物在常温下反应生成Z单质和水”可以判断为硫元素(S),“X与Y、W可分别形成YX3和XW型共价化合物,YX3极易溶于水及XW与YX3反应生成一种盐”可以判断Y为氮元素(N),W为氯元素(Cl),即YX3和XW分别为NH3和HCl,二者结合生成NH4Cl,溶于水发生水解,溶液显酸性,pH小于7,水中存在氢键,沸点比H2S高;“X单质和Y单质反应生成YX3是可逆反应”达到平衡后v正=v逆,a正确;设在反应任一时刻N2反应的物质的量为x,
N2+3H2![]() 2NH3
2NH3
1 3
X 3x 2x
1-x 3-3x 2x
则N2的体积分数为![]() ×100%=50%,b正确;c明显错误;d质量不变,气休的总物质的量减小,气体的平均相对分子质量增大,反应放热,升高温度,平衡向逆反应方向移动,NH3的体积分数减小,e错误。
×100%=50%,b正确;c明显错误;d质量不变,气休的总物质的量减小,气体的平均相对分子质量增大,反应放热,升高温度,平衡向逆反应方向移动,NH3的体积分数减小,e错误。
答案:(1)N
![]()
(3)小于![]() +H2O
+H2O![]() NH3·H2O+H+
NH3·H2O+H+
(4)低 Cu2++H2S![]() CuS↓+2H+
CuS↓+2H+
(5)ab


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:阅读理解


| ||
| ||
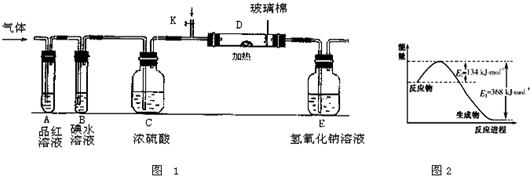
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
18 8 |
18 8 |
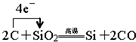

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com