
| A. | 混合物 | B. | 单质 | C. | 氧化物 | D. | 化合物 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2017届广东省山一高三上第二次统测化学试卷(解析版) 题型:选择题
类推的思维方法在化学学习与研究中经常用到,但有时会产生错误的结论。因此,推出的结论最终要经过实践的检验才能决定其是否正确。以下几种类推结论中,正确的是( )
A. 第二周期元素氢化物的稳定性顺序是:HF>H2O>NH3;则第三周期元素氢化物的稳定性顺序也是:HCl>H2S>PH3
B. 第ⅣA族元素氢化物沸点顺序是:GeH4>SiH4>CH4;则第ⅤA族元素氢化物沸点顺序也是:AsH3>PH3>NH3
C. Fe3O4可以写成FeO·Fe2O3;Pb3O4也可以写成PbO·Pb2O3
D. NaHSO4与NaHSO3溶液显酸性,则所有酸式盐溶液均显酸性
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
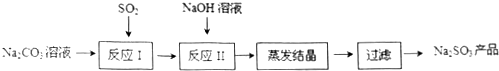
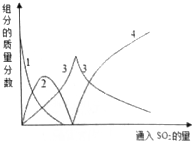
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| t/s | 0 | t1 | t2 | t3 | t4 |
| n(SO3)/mol | 0 | 0.8 | 1.4 | 1.6 | 1.6 |
| A. | 反应在0~t1s内的平均速率v(SO2)=$\frac{0.8}{{t}_{1}}$mol•L-1•s-1 | |
| B. | 保持其他条件不变,若增大O2的浓度,到达新平衡时SO2转化率会增大 | |
| C. | 平衡时,再向容器中充入0.4mol SO2和1.6mol SO3,平衡不移动 | |
| D. | 保持温度不变,向该容器中再充入2 mol SO2、1mol O2,反应到达新平衡时$\frac{n(S{O}_{3})}{n({O}_{2})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液.| 试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 沸点(℃) | 34.7 | 78.5 | 118 | 77.1 |
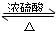 CH3CO18OC2H5+H2O.
CH3CO18OC2H5+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{1}{2}$N2H4+$\frac{1}{2}$O2═$\frac{1}{2}$N2+H2O△H=-267 kJ•mol-1 | |
| B. | N2H4(g)+O2(g)═N2(g)+2H2O(l)△H=-133.5 kJ•mol-1 | |
| C. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=+534 kJ | |
| D. | N2H4(g)+O2(g)═N2(g)+2H2O(g)△H=-534 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
下列说法正确的是
A.氧化还原反应一定有氧元素参加 B.氧化剂本身发生氧化反应
C.氧化反应一定先于还原反应发生 D.一定有电子转移(得失或偏移)
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4molNH3和5molO2反应,达到平衡时放出热量为905.9kJ | |
| B. | 平衡时v正(O2)=v逆(NO) | |
| C. | 平衡后降低压强,混合气体平均摩尔质量增大 | |
| D. | 平衡后升高温度,混合气体中NO含量降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com