
【题目】氢氧燃料电池是符合绿色化学理念的新型发电装置。 碱性氢氧燃料电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因为 。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2![]() 2LiH Ⅱ.LiH+H2O==LiOH+H2↑
2LiH Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②已知LiH固体密度为0.82g/cm3。用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%, 则导线中通过电子的物质的量为 mol。
【答案】
(1)由化学能转化为电能 由负极到正极
(2)2H2+4OH--4e-=4H2O或H2+2OH--2e-=2H2O
(3)增大电极单位面积吸附H2、O2分子数,加快电极反应速率
(4)①Li;H2O;②![]() 或8.71×10-4;③32
或8.71×10-4;③32
【解析】
试题分析:(1)氢氧燃料电池属于原电池,是将化学能转化为电能的装置,所以该燃料电池中能量主要转化形式是化学能转化为电能;燃料电池中,通入燃料的电极是负极、通入氧化剂的电极是正极,电子从负极沿导线流向正极,所以通入氢气的电极是负极、通入氧气的电极是正极,电子流动方向为a到b,故答案为:化学能→电能;a→b;
(2)碱性氢氧燃料电池中,负极上氢气失电子和氢氧根离子反应生成水,电极反应式为H2-2e-+2OH-=2H2O,故答案为:H2-2e-+2OH-=2H2O;
(3)反应物接触面积越大,反应速率越快,电极表面镀铂粉能增大反应物的接触面积,所以能增大反应速率,故答案为:增大电极单位面积吸附H2和O2的分子数,增大反应速率;
(4)①2Li+H2![]() 2LiH,该反应中锂失电子发生氧化反应,所以锂是还原剂;LiH+H2O=LiOH+H2↑,该反应中H2O得电子生成氢气,发生还原反应,所以H2O是氧化剂;故答案为:Li; H2O;
2LiH,该反应中锂失电子发生氧化反应,所以锂是还原剂;LiH+H2O=LiOH+H2↑,该反应中H2O得电子生成氢气,发生还原反应,所以H2O是氧化剂;故答案为:Li; H2O;
②根据2Li+H2![]() 2LiH得生成LiH的质量=
2LiH得生成LiH的质量=![]() ×2×8g=160g,LiH的体积=
×2×8g=160g,LiH的体积=![]() =200cm3,氢气体积=224L=224000cm3,所以生成的LiH体积与被吸收的H2体积比=200cm3:224000cm3=
=200cm3,氢气体积=224L=224000cm3,所以生成的LiH体积与被吸收的H2体积比=200cm3:224000cm3=![]() ,故答案为:
,故答案为:![]() ;
;
③由2Li+H2![]() 2LiH、LiH+H2O=LiOH+H2↑得若能量转化率为80%,则转化的氢气物质的量=
2LiH、LiH+H2O=LiOH+H2↑得若能量转化率为80%,则转化的氢气物质的量=![]() =8mol,最终生成氢气的物质的量是16mol氢气,则转移电子的物质的量=16mol×2=32mol,故答案为:32。
=8mol,最终生成氢气的物质的量是16mol氢气,则转移电子的物质的量=16mol×2=32mol,故答案为:32。


科目:高中化学 来源: 题型:
【题目】在番茄幼苗的培养液中,除了必需的微量元素、NH4+、PO43-和CO2外,还必需的大量元素有( )
A.C.H、O、N B.K、CA.Mg、Fe
C.Mn、Mo、Cu、Zn D.K、CA.Mg、S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示(质子交换膜只允许H+通过)。下列有关微生物电池的说法错误的是

A. 正极反应中有CO2生成
B. 微生物促进了反应中电子的转移
C. 质子通过交换膜从负极区移向正极区
D. 电池总反应为C6H12O6+6O2=6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X的原子有3个电子层,最外层有4个电子。这种元素位于周期表的
A. 第4周期ⅢA族 B. 第4周期ⅦA族 C. 第3周期Ⅳ族 D. 第3周期ⅣA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种固体物质A、B、C、D、E由下表中不同的阴阳离子组成,它们均易溶于水。
阳离子 | Na+ | Al3+ | Fe3+ | Cu2+ | Ba2+ |
阴离子 | OH- | Cl- | CO32- | NO3- | SO42- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与C溶液混合后产生蓝色沉淀,向该沉淀中加入足量稀HNO3,沉淀部分溶解,剩余白色固体;
②B溶液与E溶液混合后产生红褐色沉淀,同时产生大量气体;
③少量C溶液与D溶液混合后产生白色沉淀,过量C溶液与D溶液混合后无现象;
④B溶液与D溶液混合后无现象;
⑤将38.4 g Cu片投入装有足量D溶液的试管中,Cu片不溶解,再滴加1.6 mol/L稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现。
(1)据此推断A的化学式为:A ;
(2)写出步骤②中发生反应的离子方程式 。
(3)D溶液中滴入石蕊试液,现象是 ,原因是 (用离子方程式说明)。
(4)步骤⑤中若要将Cu片完全溶解,至少加入稀H2SO4的体积是 mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、氯及其化合物有如下转化关系,请按要求填空:

(1)金属钠的密度比水 ,实验室中金属钠通常保存在 中。一小块金属钠投入水中的反应方程式是 。
(2)Na2O2 是 色的固体,Na2O2 的重要用途是 ,有关反应的化学方程式为 。
(3)通常情况下,为了防止污染环境,在做完实验后,多余的氯气应用NaOH溶液吸收,其化学方程式为 。
(4)漂白粉的有效成份是 (填化学式),漂白粉溶于水后,受空气中的CO2作用,产生有漂白、杀菌作用的次氯酸,化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,pH=11的氨水和NaOH溶液分别加水稀释100倍,溶液的pH随溶液体积变化的曲线如图所示。据图判断错误的是( )
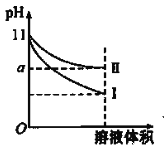
A.a的数值一定大于9
B.II为氨水稀释时溶液的pH变化曲线
C.稀释后氨水中水的电离程度比NaOH溶液中水的电离程度大
D.完全中和稀释后相同体积的两溶液时,消耗相同浓度的稀硫酸的体积V( NaOH)<V(氨水)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com