
分析 氨气的相对分子质量为17,氨气的质量为17g/mol,根据n=$\frac{m}{M}$计算出8.5g氨气的物质的量,然后根据N=nNA计算出含有的氨气分子数,最后根据V=nVm计算出标准状况下氨气的体积.
解答 解:氨气的摩尔质量为17g/mol,8.5g氨气的物质的量为:$\frac{8.5g}{17g/mol}$=0.5mol,0.5mol氨气分子中含有氨气分子的数目为:6.02×1023/mol×0.5mol=3.01××1023;标准状况下0.5mol氨气的体积为:22.4L/mol×0.5mol=11.2L,
故答案为:17g/mol;0.5;3.01××1023;22.4.
点评 本题考查了物质的量的计算,题目难度不大,明确物质的量与摩尔质量、气体摩尔体积、阿伏伽德罗常数之间的关系为解答关键,试题侧重基础知识的考查,培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 四种元素位于同一周期 | B. | 氢化物的稳定性H2Y>HZ | ||
| C. | 离子的氧化性aW3+>bX+ | D. | 原子序数:c>b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | X | Y | Z |
| ① | NaHSO4溶液 | Al(OH)3 | 稀硫酸 |
| ② | CaCl2溶液 | SO2 | CaSO3 |
| ③ | HF溶液 | Si | Ba(OH)2 |
| ④ | Fe Cl3溶液 | Fe | 浓硝酸 |
| A. | 1组 | B. | 2组 | C. | 3组 | D. | 4组 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
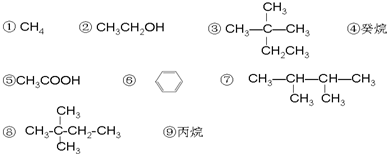
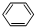 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$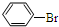 +HBr;
+HBr;查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第VⅡA族元素形成的氢化物中沸点最高的是HI | |
| B. | 第三周期元素形成的简单离子中,半径最小的是Al3+ | |
| C. | 用电子式表示HCl形成过程: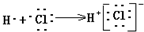 | |
| D. | 水分子很稳定性是因为水分子间易形成氢键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 如果人体缺少维生素C,易患夜盲症、干眼症等眼疾 | |
| B. | 维生素C属于脂溶性维生素,主要存在于新鲜水果和蔬菜中 | |
| C. | 维生素C具有较强的还原性,能使酸性高锰酸钾溶液褪色 | |
| D. | 富含维生素C的食物应在高温下烹调,才能充分提高维生素C的功能 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 碳 | 氮 | Y | |
| X | 硫 | Z |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com