


 .
. .
. .
. (写构简式)
(写构简式) 分析 烃A的相对分子质量为70,由$\frac{70}{12}$=5…10,则A为C5H10,核磁共振氢谱显示只有一种化学环境的氢,故A的结构简式为 ;A与氯气在光照下发生取代反应生成单氯代烃B,则B为
;A与氯气在光照下发生取代反应生成单氯代烃B,则B为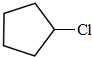 ,B发生消去反应生成C为
,B发生消去反应生成C为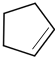 ,化合物C的分子式为C5H8,C发生氧化反应生成D为HOOC(CH2)3COOH,F是福尔马林的溶质,则F为HCHO,E、F为相对分子质量差14的同系物,可知E为CH3CHO,由信息④可知E与F发生加成反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成PPG(
,化合物C的分子式为C5H8,C发生氧化反应生成D为HOOC(CH2)3COOH,F是福尔马林的溶质,则F为HCHO,E、F为相对分子质量差14的同系物,可知E为CH3CHO,由信息④可知E与F发生加成反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成PPG(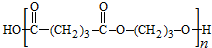 ),据此分析解答.
),据此分析解答.
解答 解:烃A的相对分子质量为70,由$\frac{70}{12}$=5…10,则A为C5H10,核磁共振氢谱显示只有一种化学环境的氢,故A的结构简式为 ;A与氯气在光照下发生取代反应生成单氯代烃B,则B为
;A与氯气在光照下发生取代反应生成单氯代烃B,则B为 ,B发生消去反应生成C为
,B发生消去反应生成C为 ,化合物C的分子式为C5H8,C发生氧化反应生成D为HOOC(CH2)3COOH,F是福尔马林的溶质,则F为HCHO,E、F为相对分子质量差14的同系物,可知E为CH3CHO,由信息④可知E与F发生加成反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成PPG(
,化合物C的分子式为C5H8,C发生氧化反应生成D为HOOC(CH2)3COOH,F是福尔马林的溶质,则F为HCHO,E、F为相对分子质量差14的同系物,可知E为CH3CHO,由信息④可知E与F发生加成反应生成G为HOCH2CH2CHO,G与氢气发生加成反应生成H为HOCH2CH2CH2OH,D与H发生缩聚反应生成PPG(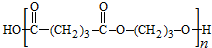 ),
),
(1)通过以上分析知,A的结构简式为 ,故答案为:
,故答案为: ;
;
(2)由B生成C的化学方程式为: ,
,
故答案为: ;
;
(3)由E和F生成G的反应类型为加成反应,A的化学名称为环己烷,故答案为:加成反应;环己烷;
(4)①由D和H生成PPG的化学方程式为: ,
,
②若PPG平均相对分子质量为10000,则其平均聚合度约为$\frac{10000}{12×8+16×4+1×12}$≈58,
故答案为: ;b;
;b;
(5)D为HOOC(CH2)3COOH,它的同分异构体中能同时满足:①能与饱和NaHCO3溶液反应产生气体,说明含-COOH,②既能发生银镜反应,又能发生水解反应,含有醛基、羧基,D中共5个C,则C-C-C上的2个H被-COOH、-OOCH取代,共为3+2=5种,含其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是 ,故答案为:5;
,故答案为:5; .
.
点评 本题考查有机物推断,为高频考点,正确判断A结构简式是解本题关键,再结合反应条件进行推断,侧重考查学生分析推断能力,难点是聚合度的计算,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中可能含有共价键 | |
| B. | 共价化合物中可能含有离子键 | |
| C. | 离子化合物中只含离子键 | |
| D. | 只含共价键的物质一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.l mol/L醋酸钙溶液中,c(Ca2+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 水电离出来的c(H+)=10-13mol/L的溶液中K+、Cl-、NO3-、I-一定能大量存在 | |
| C. | 往0.1mol/LCH3COOH溶液中通人少量HCl,醋酸的电离平衡向逆反应方向移动,且溶液中$\frac{c(C{H}_{3}COOH)}{c({H}^{+}).c(C{H}_{3}CO{O}^{-})}$增大 | |
| D. | 含等物质的量浓度的CH3COOH和CH3COONa混合溶液中:2c(H+)-c(CH3COO-)=2c(OH-)-c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2KNO3═2KNO2+O2↑ | B. | NH4HCO3═NH3↑+CO2↑+H2O | ||
| C. | 3NO2+H2O═2HNO3+NO | D. | SO2+2H2S═3S↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 断开1 mol H-H的同时断开2 mol N-H | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | N2与H2的物质的量之和是NH3的物质的量2倍 | |
| D. | 单位时间里每增加1molN2,同时增加3molH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硫酸与0.1mol/LNaOH溶液反应:H+(aq)+OH-1(aq)═H2O(l)△H=-57.3kJ•mol-1 | |
| B. | 在101KPa下氢气的标准燃烧热△H=-285.5kJ•mol-1,则水分解的热化学方程式:2H2O(l)═2H2(g)+O2(g)△H=+285.5kJ•mol-1 | |
| C. | 已知2C(s)+O2(g)═2CO(g)△H=-221kJ•mol-1,则可知C的标准燃烧热为110.5kJ•mol-1 | |
| D. | 密闭容器中,9.6g硫粉与11.2g铁粉混合加热生成硫化亚铁17.6g时,放出19.12kJ热量,则Fe(s)+S(g)═FeS(s)△H=-95.6kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 定容时俯视观察液面 | |
| B. | 容量瓶中原有少量蒸馏水 | |
| C. | 溶解所用的烧杯、玻璃棒未洗涤 | |
| D. | 转移溶液时不慎将少量液体洒落在外 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com