
【题目】碳、硫的含量影响钢铁性能。某兴趣小组用如下流程对钢样进行探究。

(1)钢样中硫元素以FeS形式存在,FeS在足量氧气中灼烧,生成的固体产物中Fe、O两种元素的质量比为21:8,则该固体产物的化学式为_____________。
(2)检验钢样灼烧生成气体中的CO2,需要的试剂是____________ (填字母)。
a.酸性KMnO4溶液 b.澄清石灰水 c.饱和小苏打溶液 d.浓H2SO4
(3)取10.00 g钢样在足量氧气中充分灼烧,将生成的气体用足量1%的H2O2溶液充分吸收,再用0.1000mol·L-1NaOH溶液滴定吸收液至终点,消耗NaOH溶液20.00mL;另取10.00g钢样在足量氧气中充分灼烧,将生成的气体通过盛有足量碱石灰的U型管(如下图),碱石灰增重0.614 g。

①用l%H2O2溶液吸收SO2,发生反应的离子方程式为___________________。
②分别计算该钢样中硫、碳元素的质量分数(写出计算过程)。
③实验测得的碳元素质量分数比真实值偏高,其可能的原因是______________(填字母)
a.U型管中生成的亚硫酸盐吸收了O2
b.碱石灰吸收了空气中的CO2
c.气体通过碱石灰的流速过快,末被充分吸收
【答案】⑴ Fe3O4
⑵ab
⑶①H2O2+SO2═2H++SO42- ② n(S)= n(SO2)=![]() n(NaOH)
n(NaOH)
=1/2×0.02000L×0.1000mol·L-1=1.000×10-3mol
w(S)= ![]() ×100%=0.32%
×100%=0.32%
m(CO2)=0.614- m(SO2)=0.550g
n(C)= n(CO2) =![]() =0.0125mol
=0.0125mol
w(C)= ![]() ×100%=1.5%
×100%=1.5%
③ab
【解析】(1) 生成的固体产物中Fe、O两种元素的质量比为21:8,则Fe、O两种元素的物质的量之比为![]() :
:![]() =
=![]() ,则该固体产物的化学式为Fe3O4,故答案为:Fe3O4;
,则该固体产物的化学式为Fe3O4,故答案为:Fe3O4;
(2)钢样灼烧生成气体中含有CO2和SO2,二氧化硫也能够使澄清石灰水变浑浊,因此需要用酸性KMnO4溶液反应除去二氧化硫后再用澄清石灰水检验,故答案为:ab;
(3)①用l%H2O2溶液吸收SO2,将二氧化硫氧化生成硫酸,反应的离子方程式为H2O2+SO2═2H++SO42-,故答案为:H2O2+SO2═2H++SO42-;
②n(S)= n(SO2)=![]() n(NaOH)=1/2×0.02000L×0.1000mol·L-1=1.000×10-3mol ,w(S)=
n(NaOH)=1/2×0.02000L×0.1000mol·L-1=1.000×10-3mol ,w(S)= ![]() ×100%=0.32% ,m(CO2)=0.614- m(SO2)=0.550g ,n(C)= n(CO2) =
×100%=0.32% ,m(CO2)=0.614- m(SO2)=0.550g ,n(C)= n(CO2) =![]() =0.0125mol ,w(C)=
=0.0125mol ,w(C)= ![]() ×100%=1.5% ,故答案为:1.5%;
×100%=1.5% ,故答案为:1.5%;
③a.U型管中生成的亚硫酸盐吸收了O2,导致碱石灰增重偏大,测得的二氧化碳偏大,碳元素质量分数比真实值偏高,正确;b.碱石灰吸收了空气中的CO2,导致碱石灰增重偏大,测得的二氧化碳偏大,碳元素质量分数比真实值偏高,正确;c.气体通过碱石灰的流速过快,末被充分吸收,导致碱石灰增重偏小,测得的二氧化碳偏小,碳元素质量分数比真实值偏低,错误;故选ab。


科目:高中化学 来源: 题型:
【题目】某溶液中有Ba2+、Mg2+、Ag+ , 现用①KOH溶液,②K2SO4溶液,③KCl溶液,将三种离子逐一沉淀并分离的过程中,用到的分离方法及次数分别是( )
A.洗涤,2次
B.过滤,2次
C.分液,3次
D.过滤,3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为实验制取少量乙酸乙酯的装置图,下列关于该实验的叙述中,不正确的是( )

A.向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇和冰醋酸
B.试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象
C.实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动
D.试管b中饱和Na2CO3溶液可吸收随乙酸乙酯蒸出的少量乙酸和乙醇
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如下图所示,则下列有关说法正确的是

A. 该有机物可以发生氧化、加成、取代等反应
B. 该有机物能与NaOH溶液反应,则1 mol该有机物能消耗2 mol NaOH
C. 该有机物的分子式为C12H14O5,且与C11H12O5一定互为同系物
D. 该有机物分子中有8种不同化学环境的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中药药剂砒霜(主要成分As2O3,微溶于水)在医疗上用于治疗急性白血病。某课题组以一种含砷精矿石粉(主要成份为As4S4、As2S3、FeS2及其它惰性杂质)为原料制取As2O3, 工艺流程简图如下:

回答下列问题:
(1)过程I中所得SO2气体可回收再利用,下列有关SO2用途的说法正确的是______。
A.工业制硫酸 B.漂白纸张 C.自来水消毒
(2)过程II中发生的反应______氧化还原反应(填“是”或“不是”)。
(3)过程V中系列操作为_______ (填化学实验基本操作名称)。
(4)①过程I中焙烧As2S3的化学反应方程式为_______________。
②过程IV中生成As2O3的离子反应方程式为_______________。
(5)有毒的AsO33-通过电解反应可转化为无毒的AsO43-。用石墨为电极,在强碱性溶液中电解含AsO33-的溶液,阳极的电极反应式为______________。
(6)测定某As2O3粗产品(含As2O5杂质)中As2O3的质量分数的实验过程如下:
a.称取m g粗产品溶解于NaOH溶液,得到含AsO33-、AsO43-的混合溶液l00mL。
b.分别移取25.00mL上述溶液,用0.02500 mol·L-1的I2标准溶液进行滴定(I2将AsO33-氧化为AsO43-,淀粉溶液为指示剂)。每次滴定开始时液面读数如图一所示,三次滴定结束时,I2标准溶液液面读数如图二图四所示。

①描述滴定终点的现象_____________________。
②粗产品中As2O3的质量分数为______________ (用含有m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图1所示。下列说法正确的是( )
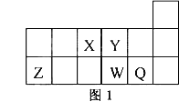
A. 元素X与元素Z的最高正化合价之和的数值等于8
B. 原子半径的大小顺序为:rX>rY>rZ>rW>rQ
C. 离子Y2-和Z 3+的核外电子数和电子层数都不相同
D. 元素W的最高价氧化物对应的水化物的酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三气体种物质的物质的量随时间的变化曲线如图所示,据此回答:

(1)该反应的化学方程式为___________
(2)从开始至2min,X的平均反应速率为________mol/(L·min)
(3)改变下列条件,可以加快化学反应速率的有_________
A.升高温度 B.减小物质X的物质的量 C.增加物质Z的物质的量. D.减小压强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com