

| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
| 3 | 63 |
| 3 |
| ||
| 3 |
| ||


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
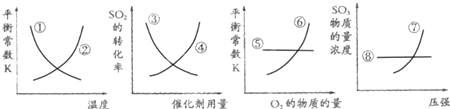
| A、①⑥⑧ | B、①⑤⑦ |
| C、②③④ | D、③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、Cu2+Na+NO
| ||||
B、Mg2+H+SO
| ||||
C、Al3+Na+HCO
| ||||
| D、Fe3+H+SCN- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
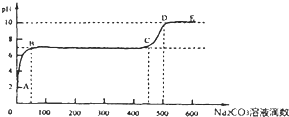
| 离子半径 | 酸性 | 还原性 | 得电子能力 |
| N3- | H2SO4 | O2- | 35Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com