
| A. | 25℃时NH4Cl溶液的Kw大于100℃时NH4Cl溶液的Kw | |
| B. | SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O═SO42-+2I- | |
| C. | 加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、AlO2-、NO3- | |
| D. | 100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液呈中性 |
分析 A.水的电离是吸热过程,升温促进电离,溶液中离子积常数增大;
B.选项中原子不守恒;
C.加入铝粉能产生氢气的溶液可以是酸或碱溶液,据此分析离子共存;
D.离子积常数随温度升高,Kw增大,盐酸和氢氧化钠是强酸强碱,等浓度等体积混合,反应生成氯化钠和水,氢氧化钠溶液过量.
解答 解:A.温度越高水的离子积常数越大,25℃时NH4Cl溶液的Kw小于100℃时NH4Cl溶液的Kw ,故A错误;
B.SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O═SO42-+2H++2I-,故B错误;
C.加入铝粉能产生氢气的溶液可以是酸或碱溶液,碱溶液中可能存在大量的Na+、Ba2+、AlO2-、NO3-,故C正确;
D.100℃时,离子积增大,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,氢离子和氢氧根离子物质的量不相同,完全反应生成氯化钠和水,氢氧根离子过量,溶液呈碱性,故D错误;
故选C.
点评 本题考查了物质性质,离子方程式正误判断,离子共存的理解应用,注意水的离子积常数随温度变化,加入铝粉能产生氢气的溶液可以是酸或碱溶液,题目难度中等.


科目:高中化学 来源: 题型:多选题
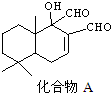
| A. | A的分子式为C15H20O3 | B. | 能发生银镜反应 | ||
| C. | 分子中有3个手性碳原子 | D. | 1molA最多与1molH2完全加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3溶液能与石灰水反应,而NaHCO3溶液不能与石灰水反应 | |
| B. | NaHCO3俗称小苏打,Na2CO3俗称苏打或纯碱 | |
| C. | Na2CO3很稳定,而NaHCO3受热时容易分解 | |
| D. | 将等物质的量的NaHCO3粉末与Na2CO3粉末同时分别倒入适量的相同浓度的稀盐酸中,前者的反应更剧烈 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
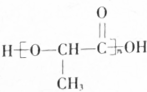 .合成N、F的路线如下:
.合成N、F的路线如下: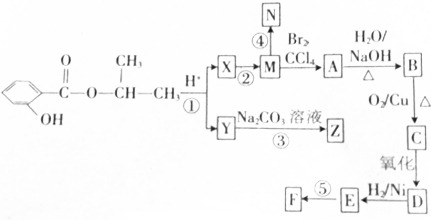
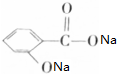 ,写出与X具有相同官能团的一种同分异构体的名称:1-丙醇.
,写出与X具有相同官能团的一种同分异构体的名称:1-丙醇. →
→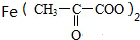 +H2↑.
+H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极反应式为:O2+2H2O+4e-═4OH- | |
| B. | 工作一段时间后,电解液中KOH的物质的量浓度不变 | |
| C. | 该燃料电池的总反应方程式为O2+2H2═2H2O | |
| D. | 用该燃料电池CuCl2溶液,产生2.24LCl2(标况)时,有0.2mol电子转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L CO2与8.5g NH3所含分子数相等 | |
| B. | 等质量的H3O+和OH-质子数之比与电子数之比相同 | |
| C. | 同温同压下,相同体积的H2和CO2的原子数之比为2:3 | |
| D. | 同温同压下,相同质量的NO和C2H4(气体)体积相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用酒精萃取碘水中的碘 | |
| B. | 分液时,把上层液体从分液漏斗上口倒出 | |
| C. | 不慎洒出的少量酒精在桌上着火时,立即用湿布盖灭 | |
| D. | 配制1.00mol/LNaCl溶液时,将称好的NaCl固体放入烧杯中溶解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com