
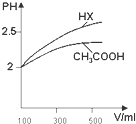
 回答下列问题:
回答下列问题:分析 (1)pH相等的酸中,加水稀释促进弱酸电离,稀释相同的倍数,pH变化大的酸性强,小的酸性弱;
(2)pH相同的两种酸,酸性越弱,酸的浓度越大,与等浓度的氢氧化钠反应消耗的体积越大.
解答 解:(1)pH相等的酸中,加水稀释促进弱酸电离,稀释相同的倍数,pH变化大的酸性强,小的酸性弱,图中HX的pH变化大,所以HX的酸性大于醋酸,则HX的电离平衡常数大于醋酸;
故答案为:大于;
(2)若用相同浓度的NaOH溶液中和等体积、等pH的这两种酸,pH相同的两种酸,酸性越弱,酸的浓度越大,与等浓度的氢氧化钠反应消耗的体积越大,HX的酸性大于醋酸,则等pH时,HX的浓度小,所以XH消耗的NaOH的体积小,即CH3COOH消耗的NaOH溶液体积大;
故答案为:CH3COOH.
点评 本题考查了弱电解质的电离,题目难度中等,明确弱电解质的电离特点、电离平衡常数与酸的电离程度的关系即可解答,试题培养了学生的灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 非金属性强弱为:X>Y>Z | |
| B. | 气态氢化物的稳定性由强到弱为X、Y、Z | |
| C. | 原子半径大小是:X<Y<Z | |
| D. | 对应阴离子的还原性按X、Y、Z顺序减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑥ | B. | ①②⑤⑥ | C. | ③⑤⑥④ | D. | ①③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只测定它的C、H比 | |
| B. | 只需证明它完全燃烧后产物只有H2O和CO2 | |
| C. | 只测定其燃烧产物中H2O与CO2的物质的量的比值 | |
| D. | 测定该试样的质量及试样完全燃烧后生成CO2和H2O的质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③④ | B. | ②③④ | C. | ②③⑤ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.03 mol | B. | 0.04 mol | C. | 0.05 mol | D. | 0.06 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验①和②均能证明K2Cr2O7溶液中存在上述平衡 | |
| B. | 实验②能说明氧化性:Cr2O72->Fe3+ | |
| C. | CrO42- 和Fe2+在酸性溶液中可以大量共存 | |
| D. | 稀释K2Cr2O7溶液时,溶液中各离子浓度均减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)/mol•L | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
| 实验编号 | T(℃) | NO初始浓度 (mol/L) | C O初始浓度 (mol/L) | 催化剂的比表面积 (m2/g) |
| 1 | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
| 2 | 124 | |||
| 3 | 350 | 124 |
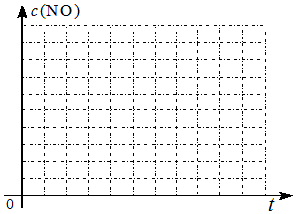
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com