
| A. | 丙烷的比例模型是 | |
| B. | 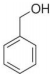 与 与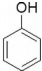 互为同系物 互为同系物 | |
| C. |  属于芳香烃 属于芳香烃 | |
| D. | 羟基的电子式为 ,1 mol-OH 含有7 mol 电子 ,1 mol-OH 含有7 mol 电子 |
分析 A.比例模型能够体现出原子体积的相对大小,题中为丙烷的球棍模型;
B.分子中含有跟链烃基或苯环侧链上的碳结合的羟基的化合物叫做醇,苯环上的氢被羟基取代而生成的化合物属酚类;
C.只含有碳氢两种元素的化合物属于烃,含有苯环的烃属于芳香烃;
D.1mol-OH含9mol电子.
解答 解:A. 为丙烷的球棍模型,丙烷的比例模型为:
为丙烷的球棍模型,丙烷的比例模型为: ,故A错误;
,故A错误;
B. 与
与 分别为醇和酚,互为同系物,故B错误;
分别为醇和酚,互为同系物,故B错误;
C. 含有苯环,所以是芳香烃,故C正确;
含有苯环,所以是芳香烃,故C正确;
D.羟基的电子式为 ,1mol-OH含9mol电子,故D错误.
,1mol-OH含9mol电子,故D错误.
故选C.
点评 本题考查了比例模型与球棍模型、同系物、电子式等表示方法的判断,题目难度中等,注意掌握比例模型与球棍模型的区别,明确电子式的概念及表示方法,能够区分结构简式与结构式、分子式.


科目:高中化学 来源: 题型:选择题
| A. | 能使石蕊溶液呈红色的溶液:Fe2+、Na+、Ba2+、Cr2O72-可以大量共存 | |
| B. | 氢氧化钡溶液与等物质的量的稀硫酸混合,离子方程式为:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 50℃,pH=1的硫酸溶液中:c(H+)=0.1mol/L | |
| D. | 25℃,pH相同的NaOH、CH3COONa、Na2CO3、NaHCO3溶液的浓度c (NaOH)<c (CH3COONa)<c (NaHCO3)<c (Na2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | x=2 | |
| B. | Fe2+、S2O32-都是还原剂 | |
| C. | 硫元素被氧化,铁元素被还原 | |
| D. | 每生成1 mol Fe2O4,则转移电子数为3 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
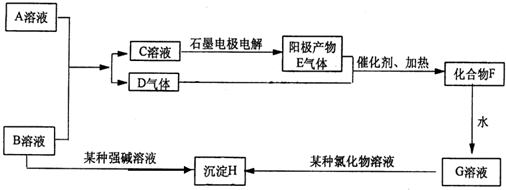
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
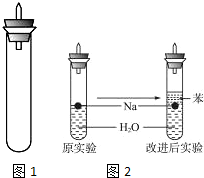 某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.为点燃上述三个反应生成的H2,他们设计了如图1所示的装置图:
某实验小组对中学课本中可生成氢气的反应进行了研究,总结出三个可以生成H2的反应:①Zn+盐酸;②Na+水;③Al+NaOH溶液.为点燃上述三个反应生成的H2,他们设计了如图1所示的装置图:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:Na>Mg>Al | B. | 热稳定性:HCl<H2S<PH3 | ||
| C. | 酸性强弱:H2SiO3<H2CO3<H3PO4 | D. | 熔点:NaCl>Na>CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com