


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:辽宁省葫芦岛一高中2012届高三上学期第一次月考化学试题 题型:013
|
在标准状况下,一个盛满空气的容器重95.3 g(已知空气的平均相对分子质量为29.0),在相同条件下若改盛满SO2气体时重98.8 g,则此容器的体积约是 | |
| [ ] | |
A. |
0.560 L |
B. |
1.12 L |
C. |
2.24 L |
D. |
3.36 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
由碳的氧化物直接合成乙醇燃料已进入大规模生产。
Ⅰ.目前工业上可以用CO2来生产CH3CH2OH。反应为:2CO2(g)+6H2(g)CH3CH2OH(g)+H2O(g),在一定压强下,该反应的一些实验数据如下表:
根据表中数据分析:
(1)该反应的正反应是_________(选填“吸热”或“放热”)反应。
(2)提高氢碳比n(H2)/n(CO2),对生成乙醇 _______(选填“不利”、“有利”或“无影响”)。
(3)在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,下列措施中能使c(CH3CH2OH)增大的是_______(填字母,下同)。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来 D.再充入1molCO2和3molH2
Ⅱ.工业上还采取以CO和H2为原料合成乙醇,其化学反应方程式为:
2CO(g)+4H2(g)CH3CH2OH(g)+H2O(g)
(4)请写出该反应的化学平衡常数表达式K= ___________。
(5)一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是___________。
A.c(CO)=c(H2) B.v正(CO)=v逆(H2O)
C.容器中的压强不变 D.消耗2molCO的同时生成1molCH3CH2OH
(6)在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。则由CO制取CH3CH2OH的优点是______________________,由CO2制取CH3CH2OH的优点是____________。(写出一点即可)
查看答案和解析>>
科目:高中化学 来源:2010年湖北省黄冈中学高二上学期期中考试试题化学 题型:填空题
由碳的氧化物直接合成乙醇燃料已进入大规模生产。
Ⅰ.目前工业上可以用CO2来生产CH3CH2OH。反应为:2CO2(g)+6H2(g) CH3CH2OH(g)+H2O(g),在一定压强下,该反应的一些实验数据如下表:
CH3CH2OH(g)+H2O(g),在一定压强下,该反应的一些实验数据如下表: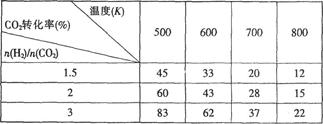
根据表中数据分析:
(1)该反应的正反应是_________(选填“吸热”或“放热”)反应。
(2)提高氢碳比n(H2)/n(CO2),对生成乙醇 _______(选填“不利”、“有利”或“无影响”)。
(3)在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,下列措施中能使c(CH3CH2OH)增大的是_______(填字母,下同)。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来 D.再充入1molCO2和3molH2
Ⅱ.工业上还采取以CO和H2为原料合成乙醇,其化学反应方程式为:
2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g)
CH3CH2OH(g)+H2O(g)
(4)请写出该反应的化学平衡常数表达式K= ___________。
(5)一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是___________。
A.c(CO)=c(H2) B.v正(CO)=v逆(H2O)
C.容器中的压强不变 D.消耗2molCO的同时生成1molCH3CH2OH
(6)在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。则由CO制取CH3CH2OH的优点是______________________,由CO2制取CH3CH2OH的优点是____________。(写出一点即可)
查看答案和解析>>
科目:高中化学 来源:2010年湖北省高二上学期期中考试试题化学 题型:填空题
由碳的氧化物直接合成乙醇燃料已进入大规模生产。
Ⅰ.目前工业上可以用CO2来生产CH3CH2OH。反应为:2CO2(g)+6H2(g) CH3CH2OH(g)+H2O(g),在一定压强下,该反应的一些实验数据如下表:
CH3CH2OH(g)+H2O(g),在一定压强下,该反应的一些实验数据如下表:

根据表中数据分析:
(1)该反应的正反应是_________(选填“吸热”或“放热”)反应。
(2)提高氢碳比n(H2)/n(CO2),对生成乙醇 _______(选填“不利”、“有利”或“无影响”)。
(3)在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,下列措施中能使c(CH3CH2OH)增大的是_______(填字母,下同)。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来 D.再充入1molCO2和3molH2
Ⅱ.工业上还采取以CO和H2为原料合成乙醇,其化学反应方程式为:
2CO(g)+4H2(g) CH3CH2OH(g)+H2O(g)
CH3CH2OH(g)+H2O(g)
(4)请写出该反应的化学平衡常数表达式K= ___________。
(5)一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是___________。
A.c(CO)=c(H2) B.v正(CO)=v逆(H2O)
C.容器中的压强不变 D.消耗2molCO的同时生成1molCH3CH2OH
(6)在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。则由CO制取CH3CH2OH的优点是______________________,由CO2制取CH3CH2OH的优点是____________。(写出一点即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
由碳的氧化物直接合成乙醇燃料已进入大规模生产。
Ⅰ.目前工业上可以用CO2来生产CH3CH2OH。反应为:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+H2O(g),在一定压强下,该反应的一些实验数据如下表:
CH3CH2OH(g)+H2O(g),在一定压强下,该反应的一些实验数据如下表:
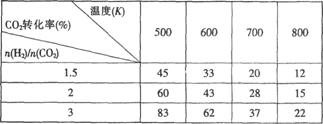
根据表中数据分析:
(1)该反应的正反应是_________(选填“吸热”或“放热”)反应。
(2)提高氢碳比n(H2)/n(CO2),对生成乙醇 _______(选填“不利”、“有利”或“无影响”)。
(3)在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,下列措施中能使c(CH3CH2OH)增大的是_______(填字母,下同)。
A.升高温度 B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离出来 D.再充入1molCO2和3molH2
Ⅱ.工业上还采取以CO和H2为原料合成乙醇,其化学反应方程式为:
2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g)
CH3CH2OH(g)+H2O(g)
(4)请写出该反应的化学平衡常数表达式K= ___________。
(5)一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是___________。
A.c(CO)=c(H2) B.v正(CO)=v逆(H2O)
C.容器中的压强不变 D.消耗2molCO的同时生成1molCH3CH2OH
(6)在相同条件下,由CO制取CH3CH2OH的平衡常数远远大于由CO2制取CH3CH2OH的平衡常数。则由CO制取CH3CH2OH的优点是______________________,由CO2制取CH3CH2OH的优点是____________。(写出一点即可)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com