
科目:高中化学 来源:2015-2016学年河北省高二上12月月考化学试卷(解析版) 题型:选择题
固体氧化物燃料电池是由美国西屋(Westinghouse)公司研制开发的。它以固体氧化锆氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过。该电池的工作原理如下图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是( )
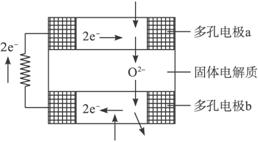
A.有O2放电的a极为电池的负极
B.有H2放电的b极为电池的正极
C.a极对应的电极反应为O2+2H2O+4e- 4OH-
4OH-
D.该电池的总反应方程式为2H2+O2 2H2O
2H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一上学期12月月考化学试卷(解析版) 题型:实验题
某NaCl样品中混有NaBr杂质,为了测定该NaCl样品的纯度,设计的实验过程如下图所示:
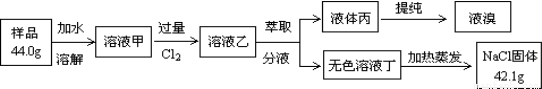
阅读上述实验过程,完成下列填空:
(1)下图装置是用来完成向溶液甲中通入过量Cl2的实验,在下面表格A、B、D下填写装置中所放的化学药品。
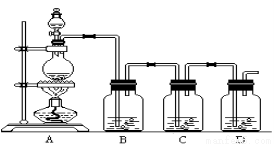
A | → | B | → | C | → | D |
溶液甲 |
(2)萃取所需要的主要玻璃仪器是_______________;
(3)溶液甲中通入Cl2的化学方程式为 ;
(4)原固体样品中氯化钠的质量分数为__________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高二上学期12月月考化学试卷(教师版) 题型:选择题
在蒸发皿中加热蒸干下列物质的水溶液并灼烧(低于400℃),可以得到该物质固体的是
A.氯化铝 B.偏铝酸钠 C.碳酸氢钾 D.高锰酸钾
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省高三上学期第六次考试理综化学试卷(解析版) 题型:实验题
肼是重要的化工原料。某探究小组利用下列反应制取水合肼(N2H4·H2O)。
CO(NH2) 2+ 2NaOH + NaClO = Na2CO3 + N2H4·H2O + NaCl
实验一: 制备NaClO溶液
(1)将氯气通入到盛有NaOH的锥形瓶中,锥形瓶中发生反应的离子方程式是_______________;
实验二: 制取水合肼(实验装置如图所示)
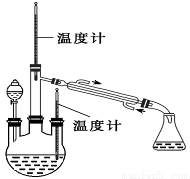
控制反应温度,将分液漏斗中溶液缓慢滴入三颈烧瓶中,充 分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。
(已知:N2H4·H2O + 2NaClO = N2↑ + 3H2O + 2NaCl)
(2)分液漏斗中的溶液是 (填标号A或B);
A.NaOH和NaClO混合溶液
B.CO (NH2) 2溶液
选择的理由是 ;
实验三: 测定馏分中肼含量
水合肼具有还原性,可以生成氮气。测定水合肼的质量分数可采用下列步骤:
a.称取馏分5.000g,加入适量NaHCO3固体,经稀释、转移、定容等步骤,配制250mL溶液。
b.移取25.00 mL于锥形瓶中,加入10mL水,摇匀.
c.用0.2000mol/L碘溶液滴定至溶液出现微黄色且半分钟内不消失,滴定过程中,溶液的pH保持在6.5左右。记录消耗碘的标准液的体积。
d.进一步操作与数据处理
(3)水合肼与碘溶液反应的化学方程式 ;滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是
(4)滴定时,碘的标准溶液盛放在 滴定管中(选填:“酸式”或“碱式”) ;若本次滴定消耗碘的标准溶液为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数
为 (保留三位有效数字);
(5)为获得更可靠的滴定结果,步骤d中进一步操作主要是: 。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高三上学期12月月考理综化学试卷(解析版) 题型:推断题
【选修—有机化学基础】
A是一种五元环状化合物,其核磁共振氢谱只有一个峰;X是一种良好的溶剂;F的核磁共振氢谱有3个峰,峰面积之比为2:2:3;G是一种合成橡胶和树脂的重要原料。A→G转化关系如下:

已知 :
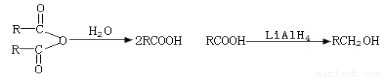
请填写下列空白。
(1)写出A的结构简式: ,1molA和足量的H2反应最多消耗掉H2的物质的量为 。
(2)B中含有非氧官能团的名称是______________;⑤的反应类型是___________。
(3)G按系统命名法应命名为_________________。
(4)若E在一定条件下能脱水生成六元环状化合物,写出该六元环化合物的结构简式:_______________________。
(5)反应⑥的化学方程式为 ________。
(6)有机物H与E互为同分异构体,且官能团的种类和数目相同,写出所有符合条件的H的结构简式: __ ______。
查看答案和解析>>
科目:高中化学 来源:2016届山东省临沂市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列物质的使用不涉及化学变化的是
A.铝热剂焊接钢轨 B.黏土烧结制陶瓷
C.氢氟酸刻蚀玻璃 D.甘油作护肤保湿剂
查看答案和解析>>
科目:高中化学 来源:2016届浙江省金丽衢十二校高三上学期第一次联考化学试卷(解析版) 题型:填空题
Ⅰ.请回答:
(1)燃着的钠不能用CO2灭火,其理由 (用化学方程式表示)。
(2)完成以下氧化还原反应的离子方程式:
( )Fe3++( )ClO-+______=( )FeO42-+( )Cl-+( )H2O
(3)剧毒物氰化钠的电子式为 ,碳元素的化合价为 ;用ClO2处理泄漏的氰化钠,得到无毒的NaCl、N2和CO2。若处理4×10-5mol·L-1的废水1000L,至少需要ClO2的质量为 g。
,碳元素的化合价为 ;用ClO2处理泄漏的氰化钠,得到无毒的NaCl、N2和CO2。若处理4×10-5mol·L-1的废水1000L,至少需要ClO2的质量为 g。
II.化合物A是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:
A(s)+H2(g) B(s)+LiH(s) ΔH= -44.5kJ•mol-1……①
B(s)+LiH(s) ΔH= -44.5kJ•mol-1……①
已知:①在液氨中加入金属锂生成B和氢气;
②一定条件下,2.30g固体B与5.35gNH4Cl固体恰好完全反应,生成固体盐C和4.48L气体D (已折算成标准状况);气体D能使湿润的红色石蕊试纸变蓝色。
(1)A的化学式为 ,LiH中r(Li+) r(H-)(填“大于”或“小于”)。
(2)写出液氨与金属锂反应的化学方程式 。
(3)B在加强热时生成NH3和另一种化合物E,该分解反应的化学方程式为 。
(4)化合物E也可以作储氢材料,其储氢原理可表示为:
E(s)+H2(g) A(s)+LiH(s) ΔH= -165kJ·mol-1…………②
A(s)+LiH(s) ΔH= -165kJ·mol-1…………②
储氢材料可以通过加热的方式释放氢气。从实用化角度考虑,选择 (填“A”或“E”)作储氢材料更合理,理由是 。
查看答案和解析>>
科目:高中化学 来源:2016届安徽省高三上第四次月考化学试卷(解析版) 题型:填空题
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大。

Ⅰ.(1)X位于元素周期表中的位置______________;W的基态原子核外有_________个未成对电子。
(2)X的单质和Y的单质相比,熔点较高的是__________(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是___________(写化学式)。
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是 ____________。
Ⅱ.部分化学键的键能见下表:
化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
键能/ kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
(1)比较下列两组物质的熔点高低(填“”“”)SiC________Si;SiCl4________SiO2
(2)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g) Si(s)+4HCl(g),
Si(s)+4HCl(g),
计算该反应的反应热△H=_________kJ·mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com