
| 催化剂 |


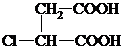 ,J为NaOOC-CH=CH-COONa,K为HOOC-CH=CH-COOH.A(乙烯)转化得到B,B能发生催化氧化,结合信息可知D为CH3CHO,C为CH3CH2OH,E为CH3CH=CH2CHO,F为CH3CH2CH2CH2OH,可推知L为CH3CH2CH2CH2OOOC-CH=CH-COOCH2CH2CH2CH3,故M为
,J为NaOOC-CH=CH-COONa,K为HOOC-CH=CH-COOH.A(乙烯)转化得到B,B能发生催化氧化,结合信息可知D为CH3CHO,C为CH3CH2OH,E为CH3CH=CH2CHO,F为CH3CH2CH2CH2OH,可推知L为CH3CH2CH2CH2OOOC-CH=CH-COOCH2CH2CH2CH3,故M为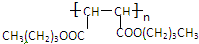 ,结合对应物质的结构和性质以及题目要求解答该题.
,结合对应物质的结构和性质以及题目要求解答该题.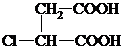 ,J为NaOOC-CH=CH-COONa,K为HOOC-CH=CH-COOH.A(乙烯)转化得到B,B能发生催化氧化,结合信息可知D为CH3CHO,C为CH3CH2OH,E为CH3CH=CH2CHO,F为CH3CH2CH2CH2OH,可推知L为CH3CH2CH2CH2OOC-CH=CH-COOCH2CH2CH2CH3,故M为
,J为NaOOC-CH=CH-COONa,K为HOOC-CH=CH-COOH.A(乙烯)转化得到B,B能发生催化氧化,结合信息可知D为CH3CHO,C为CH3CH2OH,E为CH3CH=CH2CHO,F为CH3CH2CH2CH2OH,可推知L为CH3CH2CH2CH2OOC-CH=CH-COOCH2CH2CH2CH3,故M为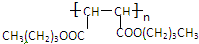 ,
,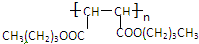 ,故答案为:
,故答案为: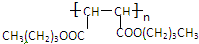 ;
;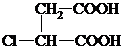 的消去反应,方程式为
的消去反应,方程式为 ,
,| 浓硫酸 |
| △ |
 ;
;| 浓硫酸 |
| △ |


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:
| A、电路中共转移1.2NA个电子 |
| B、阳极得到的气体中O2的物质量为0.2mol |
| C、阴极质量增加3.2g |
| D、电解后剩余硫酸溶液的浓度为0.5 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1.12L |
| B、1.68L |
| C、2.24L |
| D、3.36L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:
浓度/mol/L 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 【化学-选修5:有机化学基础】
【化学-选修5:有机化学基础】查看答案和解析>>
科目:高中化学 来源: 题型:
 《全球科技经济瞭望》报道了美国氢燃料电池技术的发展.科学家预测“氢能”将是未来21世纪最理想的新能源,氢能是利用氢气的燃烧反应放热提供能量.
《全球科技经济瞭望》报道了美国氢燃料电池技术的发展.科学家预测“氢能”将是未来21世纪最理想的新能源,氢能是利用氢气的燃烧反应放热提供能量.| 1 |
| 2 |
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com