
分析 (1)根据元素的电负性在周期表中的递变规律以及晶体的类型与熔沸点的关系解答该题;
(2)A.由CH4变为CO2,碳原子杂化类型由sp3转化为sp;
B.CH4为正四面体,H2O分子的空间结构为V形,CO2的空间结构为直线形;
C.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素;
D.根据B的最外层电子数及形成的共价键数判断;
(3)判断Mn2+离子的原子核外3d轨道上是否含有电子来判断是否有颜色;
(4)C≡C键中含有1个δ键,2个π键,C=O键中含有1个δ键,1个π键;C≡C碳采用sp杂化,-COOH采用sp2杂化;
(5)根据生成物判断形成的化学键;
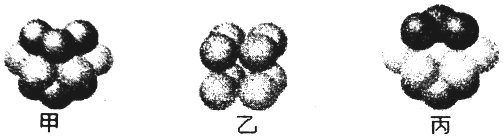
(6)某元素的原子的M能层为全充满状态,且N层电子只有一种运动状态,即N层只有一个电子,则外围电子排布为3d104s1,为铜元素,如图丙为铜型晶体的堆积方式,为面心立方堆积,在铜晶胞中,铜原子数为$\frac{1}{8}$×8+6×$\frac{1}{2}$=4,若铜晶体中一个晶胞的边长为a cm,根据ρ=$\frac{m}{V}$计算.
解答 解:(1)同周期元素从左到右元素的电负性逐渐增强,则电负性:O>N>C,同主族元素从上到下电负性逐渐减弱,则电负性:C>Si,则有N>O>Si,C60是分子晶体,而金刚石是原子晶体,原子晶体的熔沸点远大于分子晶体,
故答案为:O>N>Si;金刚石;
(2)A.由CH4变为CO2,碳原子杂化类型由sp3转化为sp,反应前后碳原子的轨道杂化类型已经改变,故A错误;
B.CH4分子中C原子在中心,四个H原子在四面体的顶点上,分子结构为正四面体,H2O分子中O原子含有2个孤电子对,分子的空间结构为V形,CO2的结构式为O=C=O,分子空间结构为直线形,故B正确;
C.同一周期元素中,元素的第一电离能随着原子序数的增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素,这几种元素都是第二周期元素,它们的族序数分别是:第IIIA族、第IVA族、第VA族、第VIA族,所以它们的第一电离能大小顺序是N>O>C>B,故C正确;
D.B的最外层电子数为3,能形成的3个共价键,化合物A(H3BNH3)中B与H形成3个共价键,B原子的空轨道与N原子的孤对电子形成配位键,故D正确;
故答案为:A;
(3)Mn2+离子的原子核外排布式为1s22s22p63s23p63d5,其d轨道上有5的电子,故[Mn(H2O)6]2+ 有颜色,
故答案为:有;
(4)C≡C键中含有1个δ键,2个π键,C=O键中含有1个δ键,1个π键,则H-C≡C-COOH分子内含有6个σ键、3个π键,碳碳三键两端的碳原子价层电子对数是2,为sp杂化,C=O键中碳原子价层电子对数是3,所以存在sp2杂化,
故答案为:6、3;sp和sp2;
(5)Fe(CO)5在一定条件下发生分解反应:Fe(CO)5═Fe(s)+5CO,反应生成Fe,则形成金属键,
故答案为:金属键;
(6)某元素的原子的M能层为全充满状态,且N层电子只有一种运动状态,即N层只有一个电子,则外围电子排布为3d104s1,为铜元素,如图丙为铜型晶体的堆积方式,为面心立方堆积,在铜晶胞中,铜原子数为$\frac{1}{8}$×8+6×$\frac{1}{2}$=4,若铜晶体中一个晶胞的边长为a cm,则铜晶体的密度为ρ=$\frac{m}{V}$=$\frac{\frac{64×4}{{N}_{A}}}{{a}^{3}}$g/cm3=$\frac{256}{{a}^{3}{N}_{A}}$g/cm3;
故答案为:丙;$\frac{256}{{a}^{3}{N}_{A}}$.
点评 本题考查了物质结构和性质,涉及电离能、等电子体、分子结构、杂化轨道、配合物、晶胞结构与计算等,为常考知识点,注意掌握中学常见配合物,晶胞结构需要学生具有一定的空间想象能力,侧重对学生综合能量的考查,难度中等.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:多选题
| A. | 1:3:6 | B. | 2:1:6 | C. | 3:5:12 | D. | 1:1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 附近居民切忌惊慌,用毛巾护住口鼻,朝顺风方向或向避风的沟塘低洼处转移 | |
| B. | 要快速地将翻落的氯槽罐安全起吊移到水池,进行碱液稀释中和 | |
| C. | 液氯流淌速度很慢,居民不必惊慌,可以放心退到家中,关紧门窗 | |
| D. | 检修或现场抢救时,没有防毒面具,可以佩戴用浓碱溶液浸过的湿口罩 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 序号 | 反应温 度/℃ | 参加反应的物质 | ||||
| Na2S2O3 | H2SO4 | H2O | ||||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| A | 20 | 10 | 0.1 | 10 | 0.1 | 0 |
| B | 20 | 5 | 0.1 | 10 | 0.1 | 5 |
| C | 20 | 10 | 0.1 | 5 | 0.1 | 5 |
| D | 40 | 5 | 0.1 | 10 | 0.1 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (或
(或
 ).
).
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3.12g | B. | 4.28g | C. | 4.68g | D. | 5.08g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂和蛋白质是人体必需的营养物质,都属于高分子化合物 | |
| B. | 食品包装袋中常有硅胶、生石灰、还原铁粉等,其作用都是吸水防止食品变质 | |
| C. | 采用催化转化技术,可将汽车尾气中的一氧化碳和氮氧化物转化为无毒气体 | |
| D. | 中医古籍《肘后备急方》中“青蒿一握,以水二升渍,绞取汁,尽服之”启发了屠呦呦采用低温提取青蒿素,该提取过程属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNH5中含有5NA个N-H键 | |
| B. | NH5中既含有共价键,又含有离子键,是离子化合物 | |
| C. | NH5的熔、沸点高于NH3 | |
| D. | NH5固体投入少量水中可产生两种气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com