
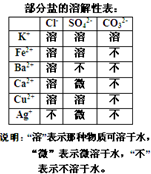
 某混合物澄清透明的水溶液中,可能含有以下离子中若干种:K+、Ca2+、Fe2+、Cu2+、Cl-、CO32-、SO42-,现每次取该溶液100.00mL溶液进行以下实验:
某混合物澄清透明的水溶液中,可能含有以下离子中若干种:K+、Ca2+、Fe2+、Cu2+、Cl-、CO32-、SO42-,现每次取该溶液100.00mL溶液进行以下实验:分析 ①第一份加入AgNO3溶液发现有沉淀生成,能和银离子反应生成白色沉淀的微粒有Cl-、CO32-、SO42-;
②第二份加足量BaCl2溶液生成沉淀,洗涤后干燥得沉淀6.27g,再将该沉淀加入足量盐酸溶解后再过滤洗涤干燥得沉淀2.33g,能和钡离子生成沉淀的有CO32-、SO42-,碳酸钡能溶于稀盐酸、硫酸钡不溶于稀盐酸,生成的沉淀部分溶于稀盐酸、部分不溶于稀盐酸,说明溶液中一定含有CO32-、SO42-,反应前混合溶液澄清,则溶液中不存在能和碳酸根离子、硫酸根离子反应的离子,如Ca2+、Fe2+、Cu2+,溶液呈电中性,所以一定含有K+,根据以上分析不能确定是否含有氯离子,n(BaSO4)=$\frac{2.33g}{233g/mol}$=0.01mol,n(BaCO3)=$\frac{6.27g-2.33g}{197g/mol}$=0.02mol,据此分析解答.
解答 解:①第一份加入AgNO3溶液发现有沉淀生成,能和银离子反应生成白色沉淀的微粒有Cl-、CO32-、SO42-;
②第二份加足量BaCl2溶液生成沉淀,洗涤后干燥得沉淀6.27g,再将该沉淀加入足量盐酸溶解后再过滤洗涤干燥得沉淀2.33g,能和钡离子生成沉淀的有CO32-、SO42-,碳酸钡能溶于稀盐酸、硫酸钡不溶于稀盐酸,生成的沉淀部分溶于稀盐酸、部分不溶于稀盐酸,说明溶液中一定含有CO32-、SO42-,反应前混合溶液澄清,则溶液中不存在能和碳酸根离子、硫酸根离子反应的离子,如Ca2+、Fe2+、Cu2+,溶液呈电中性,所以一定含有K+,根据以上分析不能确定是否含有氯离子,n(BaSO4)=$\frac{2.33g}{233g/mol}$=0.01mol,n(BaCO3)=$\frac{6.27g-2.33g}{197g/mol}$=0.02mol,
(1)通过以上分析知,可能存在的离子是Cl-,故答案为:Cl-;
(2)通过以上分析知,一定存在的阳离子是K+,如果溶液中没有氯离子,则此时钾离子浓度最低,根据电荷守恒得c(K+)=$\frac{\frac{0.01mol×2+0.02mol×2}{1}}{0.1L}$=0.6mol/L,
故答案为:K+;0.6;
(3)通过以上分析知,一定存在的阴离子是CO32-、SO42-,根据原子守恒得n(CO32-)=n(BaCO3)=0.02mol、n(SO42-)=n(BaSO4)=0.01mol,则c(CO32-)=$\frac{0.02mol}{0.1L}$=0.1mol/L、n(SO42-)=$\frac{0.01mol}{0.1L}$=0.1mol/L,
故答案为:CO32-、SO42-;0.2;0.1.
点评 本题以常见阴阳离子判断为载体考查物质的量浓度计算,为高频考点,明确离子共存条件、离子性质是解本题关键,注意原子守恒的灵活运用,题目难度不大.


 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:解答题
| 金刚石 | 晶体硅 | 晶体硼 | |
| 熔点/K | >3 823 | 1 683 | 2 573 |
| 沸点/K | 5 100 | 2 628 | 2 823 |
| 硬度/Moh | 10 | 7.0 | 9.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
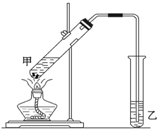 在实验室里用乙醇、冰醋酸和浓硫酸来制备一种有香味的物质,实验装置如图所示,请根据要求作答.
在实验室里用乙醇、冰醋酸和浓硫酸来制备一种有香味的物质,实验装置如图所示,请根据要求作答.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
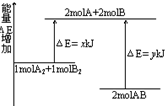
| A. | 该反应是吸热反应 | |
| B. | 生成2molAB需要吸收热量y-x kJ | |
| C. | 断裂1molA-A键和1molB-B键可放出xkJ能量 | |
| D. | 断裂2molA-B键需要吸收ykJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物可能含有共价键 | B. | 共价化合物可能含有离子键 | ||
| C. | 离子化合物只含有离子键 | D. | 以上说法均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeBr2溶液中通入过量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| B. | Fe3O4 与稀硝酸反应:Fe3O4+8H+=2Fe3++Fe2++4H2O | |
| C. | 碳酸氢铵溶液与足量烧碱溶液共热:NH${\;}_{4}^{+}$+OH$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O | |
| D. | 将过量氨水中加入氯化铁溶液中:Fe3++3NH3•H2O═Fe(OH)3↓+3NH${\;}_{4}^{+}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷 | B. | 乙烯 | C. | 乙烷 | D. | 丙烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com