
N2+3H2 2NH3是目前工业上合成氨的反应,下列关于该反应的说法正确的是( )
2NH3是目前工业上合成氨的反应,下列关于该反应的说法正确的是( )
|
| A. | 增加N2的浓度能加快反应速率 |
|
| B. | 降低体系温度能加快反应速率 |
|
| C. | 使用催化剂不影响反应速率 |
|
| D. | 若反应在密闭容器中进行,N2和H2能100%转化为NH3 |
科目:高中化学 来源: 题型:
由乙烯和乙醇蒸汽组成的混合气体中,若碳元素的质量分数为72%,则氧元素的质量分数为( )
|
| A. | 32.00% | B. | 16.00% | C. | 14.22% | D. | 2.14% |
查看答案和解析>>
科目:高中化学 来源: 题型:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,
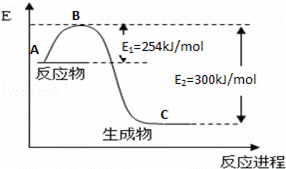
(1)如图是N2(g)和H2(g)反应生成1mol NH3(g)过程中能量变化示意图,请写出N2和H2反应的热化学方程式: ;
(2)若已知下列数据:
| 化学键 | H﹣H | N≡N |
| 键能/kJ•mol﹣1 | 435 | 943 |
试根据表中及图中数据计算N﹣H的键能 kJ•mol﹣1
(3)合成氨反应通常用铁触媒作催化剂.使用铁触媒后E1和E2的变化是:E1 ,E2 (填“增大”、“减小、”“不变”).
(4)用NH3催化还原NOX还可以消除氮氧化物的污染.例如
4NH3(g)+3O2(g)=2N2(g)+6H2O(g);△H1=akJ/mol
N2(g)+O2(g)=2NO(g);△H2=bkJ/mol
若1mol NH3还原NO至N2,则该反应过程中的反应热△H3= kJ/mol(用含a、b的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
著名物理化学家张存浩院士获得2013年国家最高科学技术奖,他在氟化氢(氘)激光器和水煤气合成液体燃料研究等方面做出了重要贡献.
①氟化氢(HF)的水溶液能雕刻玻璃.制备普通玻璃的主要原料有SiO2、CaCO3、 (填化学式).
②水煤气的主要成分是CO和H2,在40MPa、380℃、锌铬氧化物做催化剂的条件下,用CO和H2合成液体燃料CH3OH,该反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
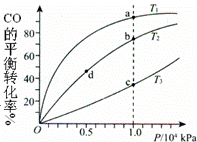
用CO和H2合成CH3OH的化学方程式为CO(g)+2H2(g)═CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
|
| A. | 温度:T1>T2>T3 |
|
| B. | 正反应速率:υ(a)>υ(c) υ(b)>υ(d) |
|
| C. | 平衡常数:K(a)>K(c) K(b)=K(d) |
|
| D. | 平均摩尔质量:M(a)<M(c) M(b)<M(d) |
查看答案和解析>>
科目:高中化学 来源: 题型:
Na2S2O3·5H2O可作为高效脱氯剂,工业上用硫铁矿(FeS2)为原料制备该物质的流程如下。

已知:I.气体A可以使品红溶液褪色,与硫化氢(H2S)混合能获得单质硫。
II.pH约为11的条件下,单质硫与亚硫酸盐可以共热生成硫代硫酸盐。
回答下列问题:
(1)沸腾炉中将粉碎的硫铁矿用空气吹动使之达到“沸腾”状态,其目的是 。
(2)吸收塔中的原料B可以选用 (填字母序号)。
A.NaCl溶液 B.Na2CO3溶液 C.Na2SO4溶液
(3)某小组同学用下图装置模拟制备Na2S2O3 的过程(加热装置已略去)。
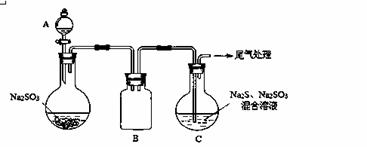
① A中使用70%的硫酸比用98%的浓硫酸反应速率快,其原因是 。装置B的作用是 。
② C中制备Na2S2O3发生的连续反应有:Na2S + H2O + SO2 ===Na2SO3 +H2S、
和Na2SO3 + S  Na2S2O3 。
Na2S2O3 。
(4)工程师设计了从硫铁矿获得单质硫的工艺,将粉碎的硫铁矿用过量的稀盐酸浸取,得到单质硫和硫化氢气体,该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:2H2(g)+O2(g)====2H2O(l)
ΔH=-571.6 kJ·mol-1 ①
2CH3OH(l)+3O2(g)====2CO2(g)+4H2O(l)
ΔH=-1 452 kJ·mol-1 ②
H+(aq)+OH-(aq)====H2O(l) ΔH=-57.3 kJ·mol-1 ③
下列说法正确的是( )
A.H2(g)的燃烧热ΔH=-571.6 kJ·mol-1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.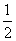 H2SO4(aq)+
H2SO4(aq)+ 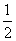 Ba(OH)2(aq)====
Ba(OH)2(aq)====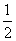 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)====CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com