
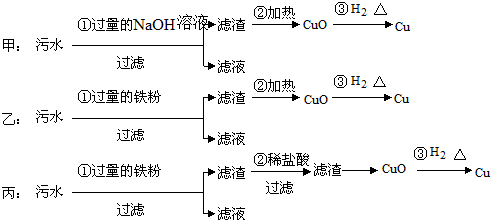
分析 (1)根据绿色化学的含义判断,绿色化学是指环境友好化学,即无污染,其核心是从源头上消除污染;
(2)根据大型化工企业的特点需要大量的水源,进出货物需方便即交通运输方便,还有可能污染环境,所以要远离居民区;
(3)丙方案中的第③步由于汞的沸点低、易挥发、有毒,因此会导致环境污染.
解答 解:(1)A、处理废弃物是污染治理措施,污染已经产生,不是从源头消除污染,不符合绿色化学理念,故A错误;
B、治理污染点,污染已经产生,也不是从源头消除污染,不符合绿色化学理念,故B错误;
C、减少有毒物并没有根除有毒物质,也不是从源头消除污染,不符合绿色化学理念,故C错误;
D、杜绝污染源是从源头消除污染,符合绿色化学理念,故D正确;
故选D;
(2)A、建在干旱山区缺乏水分不利于化工企业的运作,故A错误;
B、大型化工企业必须水源充足,交通方便,故B正确;
C、不能乱选择基地,必须保证水源充足,交通方便,不能污染居民,故C错误;
D、由于大型化工企业具有污染性,不能建在居民区附近,故D正确;
故选BD;
(3)丙方案中:由于铁的活动性比铜和汞都强,所以污水中加入过量的铁粉后得滤渣的成分主要是铜、汞和剩余的铁,滤渣中铜汞不能与与盐酸反应,而铁能反应,此时滤渣就变成了铜与汞的混合物,加热汞转化成汞蒸气挥发出来,铜与氧气反应生成了氧化铜,氧化铜采用氢气还原可得纯净的铜;从该过程可以看出该步骤中③是汞的污染环节,要想防止汞污染的产生就得需要对汞蒸气进行处理,以防止汞蒸气挥发到空气中导致污染,
故答案为:丙方案的第③步;增加冷凝回收装置.
点评 本题考点较为综合,涉及绿色化学,实验方案的分析等,解题的关键是抓住实验方案设计的目的,并结合环保要求和相关的化学知识是解答的关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 第VIIA族元素由上至下其单质的沸点依次升高 | |
| B. | 第VIA族元素的最高化合价都为+6价 | |
| C. | 离核越远的电子层上的电子能量越低 | |
| D. | 所有元素的原子中都含有中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
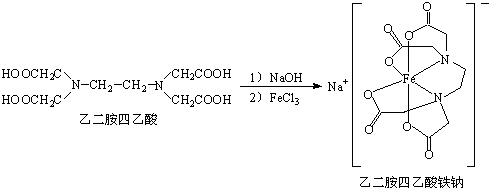
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 118号元素属于第八周期元素 | |
| B. | 118号元素是一种金属元素 | |
| C. | 118号元素的原子核中含有118个质子 | |
| D. | 118号元素原子经化学反应后可转化成其他元素的原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
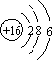 ;羰基硫分子的电子式为
;羰基硫分子的电子式为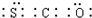 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
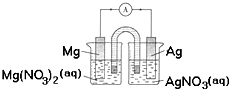
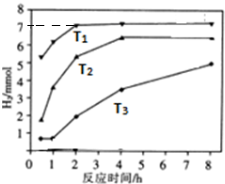
| A. | 用稀硫酸代替AgNO3溶液,也可形成原电池 | |
| B. | 银片为负极,发生的反应为:Ag++e-=Ag | |
| C. | 进行实验时,琼脂中K+移向Mg(NO3)2溶液 | |
| D. | 取出盐桥,电流表依然有偏转 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
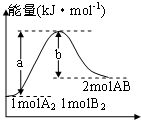
| A. | 每生成2分子AB吸收bkJ热量 | |
| B. | 该反应中反应物的总能量高于生成物的总能量 | |
| C. | 断裂1molA-A键和1molB-B键,放出a kJ能量 | |
| D. | 该反应焓变为△H=+(a-b) kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的比例模型: | B. | 氯离子的结构示意图: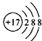 | ||
| C. | 溴原子的价层电子排布式:4s24p5 | D. | 过氧化钠的电子式: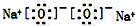 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com