
| A. | 等于α | B. | 大于α | C. | 小于α | D. | 无法确定 |
分析 先假定甲、乙的体积都不变,达到平衡后再保持乙的压强不变,此反应是气体体积减小的反应,因此,待等体积达平衡后,欲保持乙的压强不变,就需要缩小体积.缩小体积则乙的压强增大,平衡正向移动.
解答 解:先假定甲、乙的体积都不变,达到平衡后再保持乙的压强不变,此反应是气体体积减小的反应,因此,待等体积达平衡后,欲保持乙的压强不变,就需要缩小体积.缩小体积时,乙的压强增大,平衡正向移动.所以,若甲容器中SO2的转化率为α,则乙的SO2的转化率将大于甲的,即大于α.
故选B.
点评 本题考查了化学平衡的影响因素分析判断,恒温恒容、恒温恒压容器的变化特征,题目难度中等,掌握分析方法是关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
100ml 6mol/L H2SO4与过量铁粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A.Na2SO4(s) B.NaOH C.(NH4) 2SO4(s) D.CH3COONa溶液
2SO4(s) D.CH3COONa溶液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省高二上10月阶段测化学卷(解析版) 题型:选择题
下列各组物质的性质比较,正确的是
A. 酸性:HClO4>H3PO4>H2SO4 B. 氢化物稳定性:H2S>HF>H2O
C. 碱性:NaOH>Mg(OH)2>Ca(OH)2 D. 氧化性:F2 > Cl2 > Br2 > I2
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取样,滴加硫氰化钾溶液 | |
| B. | 取样,加足量的浓NaOH溶液加热,用湿润的红色石蕊试纸检验气体 | |
| C. | 取样,逐滴滴入氢氧化钠溶液直至足量 | |
| D. | 取样,加足量盐酸加热,湿润的品红试纸检验气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色液体 | B. | 可以被氧化 | ||
| C. | 能与水以任意比例混溶 | D. | 能与氢氧化钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
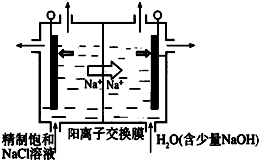 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺查看答案和解析>>
科目:高中化学 来源: 题型:解答题
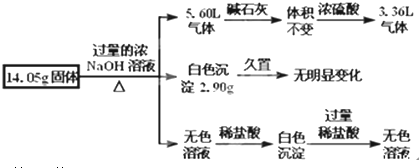
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com