
| A. | HOCH2CH(OH)CH2OU和CH3CH(Cl)CH2CH3都是手性分子 | |
| B. | NH4+与H3O+的空间构型相似 | |
| C. | BF3与苯都是平面型分子 | |
| D. | CO2和H2O都是直线型分子 |
分析 A、HOCH2CH(OH)CH2OH中两边的碳原子上都有两个氢原子,中间碳上连有两个HOCH2-基团,所以不含有手性碳;
B、NH4+中氮原子价层电子对数为$\frac{5+4-1}{2}$=4,没有孤电子对,所以其空间构型为正四面体,H3O+中氮原子价层电子对数为$\frac{6+3-1}{2}$=4,有一对孤电子对,所以空间构型为三角锥;
C、BF3分子中B原子最外层有三个电子,与氟原子形成三对共用电子对,没有孤电子对,所以分子构型为平面三角形分子,是平面型分子,苯分子有π键,形成平面六边形结构,所以是平面型分子;
D、CO2分子中C原子价层电子对数为$\frac{4}{2}$=2,分子中碳原子没有孤电子对,所以分子是直线型分子,H2O分子中O原子价层电子对数为$\frac{6+2}{2}$=4,分子中原子有两对孤电子对,所以分子是V型分子,据此答题;
解答 解:A、HOCH2CH(OH)CH2OH中两边的碳原子上都有两个氢原子,中间碳上连有两个HOCH2-基团,所以不含有手性碳,所以HOCH2CH(OH)CH2OH不是手性分子,故A错误;
B、NH4+中氮原子价层电子对数为$\frac{5+4-1}{2}$=4,没有孤电子对,所以其空间构型为正四面体,H3O+中氮原子价层电子对数为$\frac{6+3-1}{2}$=4,有一对孤电子对,所以空间构型为三角锥,故B错误;
C、BF3分子中B原子最外层有三个电子,与氟原子形成三对共用电子对,没有孤电子对,所以分子构型为平面三角形分子,是平面型分子,苯分子有π键,形成平面六边形结构,所以是平面型分子,故C正确;
D、CO2分子中C原子价层电子对数为$\frac{4}{2}$=2,分子中碳原子没有孤电子对,所以分子是直线型分子,H2O分子中O原子价层电子对数为$\frac{6+2}{2}$=4,分子中原子有两对孤电子对,所以分子是V型分子,故D错误;
故选C.
点评 本题考查物质结构和性质,为高频考点,涉及微粒空间构型判断、手性分子等,中等难度,答题时注意常见微粒的空间构型的运用.


科目:高中化学 来源: 题型:解答题
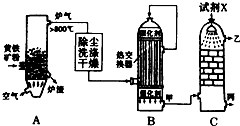 合成氨工业、硝酸工业、硫酸工业是化学工业的重要组成部分.请回答下列问题:
合成氨工业、硝酸工业、硫酸工业是化学工业的重要组成部分.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 冶炼金属钠通常用电解氯化钠溶液的方法 | |
| B. | 要使海水淡化通常有蒸馏法和离子交换法 | |
| C. | 用氯气和氢氧化钠制漂白粉 | |
| D. | 工业冶炼金属铁用铝和三氧化二铁高温下发生铝热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca→CaO→Ca Cl2 | B. | O2→CuO→Cu(OH)2 | ||
| C. | C→CO2→Na2CO3 | D. | NaOH→Na2CO3→NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
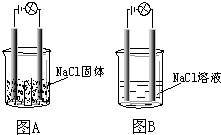 某一化学兴趣小组的同学在家中进行实验,按照图示连接好线路,发现图B中的灯泡亮了.由此得出的以下结论中正确的是( )
某一化学兴趣小组的同学在家中进行实验,按照图示连接好线路,发现图B中的灯泡亮了.由此得出的以下结论中正确的是( )| A. | NaCl是非电解质 | |
| B. | NaCl溶液是电解质 | |
| C. | NaCl在水溶液中电离出了可以自由移动的离子 | |
| D. | 在NaCl溶液中,水电离出了大量的离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O (g)═H2(g)+$\frac{1}{2}$O2(g);△H═-485 kJ/mol | B. | 2H2(g)+O2(g)═2H2O(g);△H═-485 kJ/mol | ||
| C. | 2H2(g)+O2 (g)═2H2O(g);△H═+485 kJ/mol | D. | H2O (g)═H2(g)+$\frac{1}{2}$O2(g);△H═+485 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数K1 | 1.8×10-5 | 4.3×10-7 | 3.0×10-8 |
| K2 | -- | 5.6×10-11 | -- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com