
| A.硝酸钾 | B.碳酸钾 | C.硫酸钾 | D.氯化钾[ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
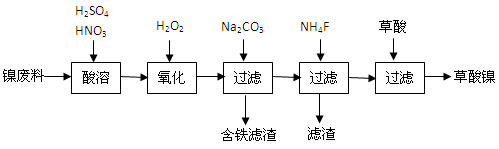
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.工业上,用焦炭在电炉中还原二氧化硅得到含杂质的粗硅 |
| B.生产普通水泥的主要原料有石灰石、石英和纯碱 |
| C.工业上将粗铜进行精炼,应将粗铜连接在电源的正极 |
| D.在高炉炼铁的反应中,一氧化碳作还原剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2 NH3 (g); △H <0, 该反应应采取的适宜条件是( )
2 NH3 (g); △H <0, 该反应应采取的适宜条件是( )| A.低温、高压、催化剂 | B.适宜的温度、高压、催化剂 |
| C.低温、常压、催化剂 | D.适宜的温度和压强、催化剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
  压强 压强SO2的 转化率 温度 | 1×105 Pa | 5×105 Pa | 10×105 Pa | 50×105 Pa | 100×105 Pa |
| 450 ℃ | 97.5% | 98.9% | 99.2% | 99.6% | 99.7% |
| 550 ℃ | 85.6% | 92.9% | 94.9% | 97.7% | 98.3% |
 的空气是为了________。
的空气是为了________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
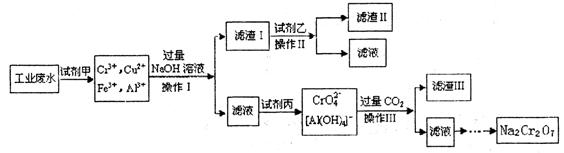
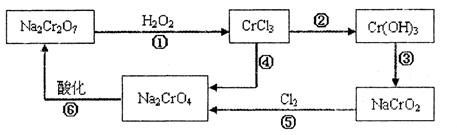
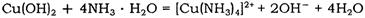
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
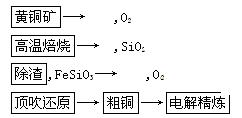
 到了NO和NO2的混合气体8.736L,与3.304LO2混合后,得到的混合气体恰好被水完全吸收。
到了NO和NO2的混合气体8.736L,与3.304LO2混合后,得到的混合气体恰好被水完全吸收。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
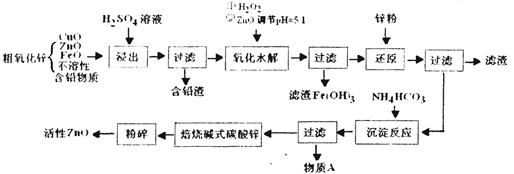
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com